1 ¿CUÁL ES LA LONGITUD DE ONDA ASOCIADA A
1.- ¿Cuál es la longitud de onda asociada a un electrón que se mueve con una velocidad de 1.000.000 Km/s? ¿A qué zona del espectro corresponde?. Sol: 0,0073 A.
2.- Explica por qué no pueden definirse órbitas en el átomo según la Mecánica cuántica.
3.- ¿Qué es un orbital? Explica las diferencias entre órbita en el átomo de Bohr y orbital en la Mecánica cuántica.
4.- Las siguientes combinaciones de números cuánticos indica cuáles representan una solución permitida de la ecuación de onda y cuáles no. Justifica la respuesta. Sol: a, c, y g.
|
|
n |
l |
m |
s |
|
a |
1 |
0 |
0 |
+1/2 |
|
b |
2 |
2 |
1 |
-1/2 |
|
c |
3 |
2 |
-2 |
-1/2 |
|
d |
3 |
-2 |
0 |
+1/2 |
|
e |
2 |
0 |
-1 |
+1/2 |
|
f |
2 |
1 |
0 |
0 |
|
g |
2 |
1 |
1 |
+1/2 |
5.- Utilizando la regla de n + l, ordena de menor a mayor energía los subniveles 3p, 3d, 4s, 4p, 4d, 4f, 5s. Sol: 3p < 4s < 3d < 4p < 5s < 4d < 4f.
6.- ¿A qué se debe el efecto llamado Zeeman?.
7.- Escribe los valores de los cuatro números cuánticos para los electrones del berilio.
8.- Escribe la configuración electrónica fundamental de un átomo que tiene 27 electrones.
Sol: 1s2 2s2 2p6 3s2 3p6 4s2 3d7.
9.-Calcula la longitud de onda correspondiente a la 2ª línea de la serie de Balmer del espectro de hidrógeno. Constante de Rydberg: R = 1,097 107 m-1. Sol: =4,86.10-7m
10.- Para ionizar el átomo de sodio se necesitan 118 Kcal/mol. Si esta energía es de procedencia luminosa, ¿cuál será la frecuencia más baja del haz luminoso capaz de efectuar la ionización?. ¿Y la longitud de onda?. Datos: Constante de Planck, h = 6,62 10-27 erg.s c=3.108 m/s 1A=10-10m. Sol: 2.420 A
11.- Calcula en electrón-voltios la diferencia de energías entre las órbitas 1s y 2p del átomo de cobre, sabiendo que la longitud de onda de la radiación emitida cuándo el electrón salta entre estos niveles es = 1,54 A. Solución: 8,06.10-3 eV
12.- El color amarillo de la luz de sodio posee una longitud de onda de 5.890A (1A = 10-8 cm). Estudia la diferencia de energías correspondientes a la transición electrónica que se produce expresada en eV/átomo. Solución: 2,11 eV
13.- La longitud de onda de un fotón de luz verde es de 5,4.10-5 cm. Calcula la energía de un mol de fotones de luz verde. Datos: h = 6,63.10-34 J.s; c = 3.108 m/s. Sol: 2,22.102 kJ/mol
14.- La constante de Rydberg (R), que aparece en la ecuación que determina 1/ vale 433.889,08 cm-1 para el He+. Calcula la frecuencia de la luz absorbida cuando un electrón sufre una transición del nivel energético n =1 al nivel energético n = 4. Sol: 1,22.1017 1/s
15.- ¿Por qué los espectros atómicos no son continuos?
16.- Calcula en electrónvoltio/átomo la diferencia de energía entre los orbitales 1s y 2p del átomo de cobre a partir de los siguientes datos: Frecuencia de la radiación emitida en la transición 2p al 1s : 1,95.1012 Hz; constante de Planck, h = 6,62 10-34 J.s; carga del electrón, e= 1,6.10-19C.
17.- Escribe el enunciado y la expresión matemática de los postulados de Bohr.
18.- ¿Qué son los números cuánticos? ¿Cuáles de los siguientes números cuánticos (listados en el orden n, l, m y s) son imposibles para un electrón en un átomo? A:(4, 2, 0, +1); B:(3, 3, -3, -1/2); C:(2, 0, +1, +1/2) y D:(4, 3, 0, +1/2).. Sol: A, B y C
19.- Los principios de Hund y de Pauli regulan las configuraciones electrónicas; expresa estos principios y aplícalos al átomo de oxígeno (Z = 8) y al ion O2-.
20.- Escribe la configuración electrónica del estado fundamental de los átomos e iones siguientes: N3-, Mg2+, Cl-, K+ y Fe. ¿Cuáles de ellos son isoelectrónicos? ¿Hay algún caso en el que existan electrones desapareados?.
Sol : N3-: 1s2 2s2 2p6 es isoelectrónico con Mg2+, Cl-: 1s2 2s2 2p6 3s2 3p6 es isoelectrónico con K+ y Fe:1s2 2s2 2p6 3s2 3p6 3d8 4s2 que tiene electrones desapareados en los orbitales 3d.
Tags: asociada a, ¿cuál, asociada, longitud
- FOTO FICHA DE INSCRICIÓN E AUTORIZACIÓN ANIMALINGUA DATOS PERSOAIS
- HOTEL DES VENTES DE CLERMONTFERRAND SARL BERNARD VASSY &
- I I I CONCURSO DE CARTELES DÍA INTERNACIONAL DE
- DIŞ TİCARET BİLGİLENDİRME SEMİNERİ 24 25 26
- Imenice Riječi Kojima Imenujemo Bića Stvari i Pojave
- UNIVERSITY OF COLORADO DENVER COLORADO MULTIPLE INSTITUTIONAL REVIEW BOARD
- KRUSTPILS NOVADA PAŠVALDĪBAS AMATPERSONĀM IZMAKSĀTAIS ATALGOJUMS 2017GADA DECEMBRIS NRPK
- MARCH 29 2007 TO THE HONORABLE THE CITY COUNCIL
- ANEXA 1 FIŞĂ PROIECT INFORMATII DESPRE PROIECT 1 TITLUL
- INFORMACIÓN PARA INFOBRAS NOMBRE DE LA OBRA “MEJORAMIENTO DE
- ZAŁĄCZNIK NR 2 DO ZAPROSZENIA DO SKŁADANIA OFERT §
- Slide the Snow Snake Soskwaypina Kona Kinepik the Snow
- REPÚBLICA DOMINICANA MINISTERIO DE OBRAS PÚBLICAS Y COMUNICACIONES “COMISIÓN
- SAILWAVE INSTRUCTIONS FOR SERIES RACE RESULTS (THERE
- PERATURAN PEMERINTAH REPUBLIK INDONESIA NOMOR 16 TAHUN 2002 TENTANG
- BRDO PRI LUKOVICI 8 1225 LUKOVICA TEL 01
- SMALL SLIDE LABELS OR EQUIVALENT (FOR 85”X11” PAPER) PTID
- LOVE IN THE TIME OF CHOLERA BY GABRIEL GARCIA
- HI MY NAME IS COURTNEY HICKS I AM 14
- ORDEN SAN8482020 DE 16 DE SEPTIEMBRE POR LA QUE
- SPORTCLICCH CHECKLISTE ORGANISATION VON SPORTVERANSTALTUNGEN RISIKOMANAGEMENT HINWEISE ZUM
- RATCLIFFE BUILDING SUITE 203 1602 ROLLING HILLS DRIVE RICHMOND
- MIGRACIÓN LABORAL GUATEMALA 1516 DE FEBRERO DE 2007 LA
- MANUEL ÁLVAREZ Y RAFAEL FERNÁNDEZ CONSUELO BARRERA MARTÍN JORGE
- 10 FAGFORBUNDET BÆRUM STREIKEUTTAK BÆRUM KOMMUNE ALM ANNA
- VIERNES 30 DE MARZO DE 2012 DIARIO OFICIAL ACUERDO
- ZAŁĄCZNIK NR 1 DO ZARZĄDZENIA NR 272005 Z DNIA
- STATE FIRE MARSHAL DIVISION FIRE EXTINGUISHER SURVEY THIS SURVEY
- 21 UWAGI METODYCZNE Z UWAGI NA FAKT ŻE DLA
- CHURCHILL NORTH PS SOCIAL MEDIA AND PUBLICITY POLICY C
 R UIMAN MÚSICA MELÓDICA DATOS PERSONALES MI NOMBRE ES
R UIMAN MÚSICA MELÓDICA DATOS PERSONALES MI NOMBRE ES PRIVATBIBLIOGRAPHIE SPRACHE & SCHRIFT ERNST KAUSEN © SEIT 1967
PRIVATBIBLIOGRAPHIE SPRACHE & SCHRIFT ERNST KAUSEN © SEIT 1967EIN POLITISIERUNGSSCHRITT DES THEATERS WIE REAGIEREN DIE THEATER AUF
WYMAGANIA NA POSZCZEGÓLNE OCENY PRZYRODA KLASA IV POZNAJEMY NASZE
 SERVICIO DE INTEGRACIÓN AMBIENTAL AUTORIZACIÓN AMBIENTAL INTEGRADA WWWNAVARRAES AUTORIZACIÓN
SERVICIO DE INTEGRACIÓN AMBIENTAL AUTORIZACIÓN AMBIENTAL INTEGRADA WWWNAVARRAES AUTORIZACIÓN EURÓPSKY PARLAMENT 2009 – 2014 COMMISSION{CONT}VÝBOR PRE KONTROLU ROZPOČTUCOMMISSION
EURÓPSKY PARLAMENT 2009 – 2014 COMMISSION{CONT}VÝBOR PRE KONTROLU ROZPOČTUCOMMISSION lmh010rproreeflexnote-environnementalesymoe
lmh010rproreeflexnote-environnementalesymoeESCOLA RAMÓN Y CAJAL ULLDECONA CURS 2020 2021
ANESTESIOLOGÍA PRÁCTICA EN PEQUEÑOS ANIMALES PROF PABLO OTERO
FORM FI235 (72014 REVISION) MICHIGAN DEPARTMENT OF AGRICULTURE AND
JUMPING AND LANDING SEQUENCE (LEADING UP TO PLYOMETRICS IN
 THE CHRISTIAN CRUSADES 10951291 SINCE THE TIME OF CONSTANTINE
THE CHRISTIAN CRUSADES 10951291 SINCE THE TIME OF CONSTANTINERegulamin Konkursu Literackiego „na Tatrzańskim Szlaku” Xiii Edycja 20172018
 WWWANGELSBARCELONACOM │ LANDSCAPE LANDSCAPE ? I NP I CAST
WWWANGELSBARCELONACOM │ LANDSCAPE LANDSCAPE ? I NP I CAST FUNCTION [WI TI COUNT] RKF45 ( RHS T0
FUNCTION [WI TI COUNT] RKF45 ( RHS T0REPUBLIC OF BULGARIA NATIONAL ASSEMBLY NATURE PROTECTION ACT
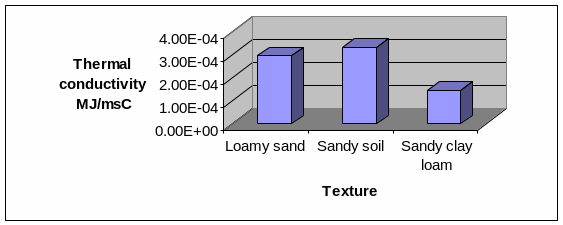 THERMAL CONDUCTIVITY OF THE SOIL AS A FUNCTION OF
THERMAL CONDUCTIVITY OF THE SOIL AS A FUNCTION OFLA INTERPRETACION DE LOS CONTRATOS EN EL DERECHO ESPAÑOL
MUNICIPALIDAD DE ROSARIO SECRETARIA DE SALUD PÚBLICA DIRECCIÓN DE
7 PSPI43121020151 PAN KRZYSZTOF DEREZIŃSKI BURMISTRZ TRZEMESZNA WYSTĄPIENIE POKONTROLNE