REACTIVO LIMITANTE 1 PARA OBTENER AMONÍACO UTILIZADO AMPLIAMENTE COMO
8 SISTEMAS HOMOGENEOS MULTICOMPONENTES NO REACTIVOS SOLUCIONES COMENCEMOS CON9 ACTIVIDADES DE REACTIVOS IMPUROS Y EN DISOLUCIÓN 1
ADJUDICACIÓN DE CONTRATO DE SUMINISTRO DE REACTIVOS DE BIOLOGÍA
ESCALA DE ESTRÉS PERCIBIDO1 10 REACTIVOS AUTOR DR SHELDON
ESPECIFICACIONES TÉCNICAS MATERIAL DE LABORATORIO Y REACTIVOS
ESPECIFICACIONES TÉCNICAS “ADQUISICIÓN DE INSUMOS Y REACTIVOS PARA DIAGNÓSTICO
Reactivo limitante
Reactivo limitante
1. Para obtener amoníaco, utilizado ampliamente como fertilizante, se deben colocar en un tanque cerrado nitruro de aluminio (AlN) y agua. La reacción de formación es la siguiente:
AlN + 3 H2O NH3 + Al(OH)3
a) Indicar cuál es la relación estequiométrica en gramos para la reacción (buscar los Ar –pesos atómicos– en la tabla periódica).
|
|
AlN |
+ |
3 H2O |
= |
NH3 |
+ |
Al(OH)3 |
|
moles |
1,0 |
|
3,0 |
|
1,0 |
|
1,0 |
|
partículas |
6,020E+23 |
|
1,806E+24 |
|
6,020E+23 |
|
6,020E+23 |
|
masa |
40,99 |
|
54,06 |
|
17,04 |
|
78,01 |
b) Si se colocaron 100 Kg. de AlN y 100 Kg. de agua, ¿Qué masa, en kilogramos, de NH3 se produjo? ¿Las cantidades utilizadas corresponden a cantidades estequiométricas? Si la respuesta es no, indicar cuál es el reactivo limitante y el reactivo en exceso. ¿Cuántos kilogramos quedaron sin reaccionar del reactivo en exceso?
Este es el típico planteo de un ejercicio que involucre un reactivo LIMITANTE y otro EN EXCESO… Si revisamos el problema 1b de la serie 1, veremos que en ése caso había un solo dato de un reactivo, mientras que en éste caso hay dos datos de reactivos. La cuestión es decidir cuál de los dos es el reactivo limitante… Entonces, se puede resolver el problema de dos maneras: considerando la cantidad de un reactivo que es necesaria para consumir la cantidad dada del otro reactivo, o viceversa… Es decir:
|
g AlN |
g H2O |
|
|
40,99 |
54,06 |
|
|
100000,00 |
131885,83 |
|
|
|
131,9 |
kg H2O |
Del cálculo anterior se desprende que para que reaccionen los 100,0 kg de AlN se necesitan 131,9 kg de H2O, que no tenemos, por cuanto el agua es el reactivo LIMITANTE y el nitruro de aluminio es el reactivo EN EXCESO.
Del mismo modo, si hacemos la cuenta desde la cantidad de agua, tenemos:
|
g H2O |
g AlN |
|
|
54,06 |
40,99 |
|
|
100000,00 |
75823,16 |
|
|
|
75,8 |
kg AlN |
|
|
24,2 |
kg AlN remanente |
En este caso, la interpretación que debemos hacer es que para que se consuman los 100 kg de agua harán falta 75,8 kg de nitruro de aluminio, que sí tenemos y hasta nos sobran 24,2 kg… Entonces, el agua es el reactivo LIMITANTE y el nitruro de aluminio es el reactivo EN EXCESO…
Respecto de la masa en kg de NH3 producido (uno de los productos), debo calcularla basada en el reactivo LIMITANTE (que es el que limita la cantidad de producto a obtener y por ello su denominación).
|
g H2O |
g NH3 |
|
|
54,06 |
17,04 |
|
|
100000,00 |
31520,53 |
|
|
|
31,5 |
kg NH3 |
También puedo realizar la cuenta basada en el reactivo en exceso, pero teniendo en cuenta no la totalidad de la masa sino la que efectivamente reacciona (dada por el reactivo limitante)…
|
g AlN |
g NH3 |
|
|
40,99 |
17,04 |
|
|
75823,16 |
31520,53 |
|
|
|
31,5 |
kg NH3 |
Con lo cual, hemos resuelto el problema…
2. El agua oxigenada se obtiene por reacción de oxígeno e hidrógeno gaseosos, según la siguiente reacción:
H2 (g) + O2 (g) H2O2 (l)
a) Indicar cuál es la relación estequiométrica en gramos para la reacción (buscar los Ar –pesos atómicos– en la tabla periódica).
|
|
H2 |
+ |
O2 |
= |
H2O2 |
|
moles |
1,0 |
|
1,0 |
|
1,0 |
|
partículas |
6,020E+23 |
|
6,020E+23 |
|
6,020E+23 |
|
masa |
2,02 |
|
32,00 |
|
34,02 |
b) Si se colocaron 250 g de hidrógeno y 100 g de oxígeno, ¿Qué cantidad de moles de H2O2 se produjo? ¿Las cantidades utilizadas corresponden a cantidades estequiométricas? Si la respuesta es no, indicar cuál es el reactivo limitante y el reactivo en exceso. ¿Cuántos gramos quedaron sin reaccionar del reactivo en exceso?
|
g H2 |
g O2 |
|
|
2,02 |
32,00 |
|
|
250,00 |
3960,40 |
No hay… |
O bien,
|
g O2 |
g H2 |
|
|
32,00 |
2,02 |
|
|
100,00 |
6,31 |
Sí hay… |
Cualquiera sea la vía elegida, queda claro que el OXÍGENO es el reactivo LIMITANTE y el hidrógeno es el reactivo en exceso…
|
g O2 |
moles H2O2 |
|
32,00 |
1,0 |
|
100,00 |
3,13 |
O bien,
|
g H2 |
moles H2O2 |
|
2,02 |
1,0 |
|
6,31 |
3,13 |
Como sea que lo calculen, se produjeron 3,13 moles de moléculas de H2O2 y sobran (250-6,31) = 243,69 g de hidrógeno.
3. La reacción del aluminio metálico con bromo, un no metal líquido, es espontánea, es decir, no necesita energía externa para que ocurra. La reacción es la siguiente:
2 Al (s) + 3 Br2 (l) 2 AlBr3 (s)
a) Indicar cuál es la relación estequiométrica en gramos para la reacción (buscar los Ar –pesos atómicos– en la tabla periódica).
|
|
2 Al (s) |
+ |
3 Br2 (l) |
= |
2 AlBr3 (s) |
|
moles |
2,0 |
|
3,0 |
|
2,0 |
|
partículas |
1,204E+24 |
|
1,806E+24 |
|
1,204E+24 |
|
masa |
53,96 |
|
479,4 |
|
533,36 |
b) Si se colocaron para reaccionar 4,00 g de aluminio y 42,00 g de bromo, ¿Cuál es la sustancia que actúa como reactivo limitante?
|
g Al |
g Br2 |
|
|
53,96 |
479,40 |
|
|
4,00 |
35,54 |
Sí hay… |
O bien,
|
g Br2 |
g Al |
|
|
479,40 |
53,96 |
|
|
42,00 |
4,73 |
No hay… |
Cualquiera sea la vía elegida, queda claro que el ALUMINIO es el reactivo LIMITANTE y el bromo es el reactivo en exceso…
c) En función de las cantidades citadas en el punto anterior, ¿Cuántos moles de bromuro de aluminio se obtuvieron?
|
g Al |
moles AlBr3 |
|
53,96 |
2,0 |
|
4,00 |
0,1 |
O bien, a partir del bromo,
|
g Br2 |
moles AlBr3 |
|
479,40 |
2,0 |
|
35,54 |
0,1 |
Como sea que lo calculen, se produjeron 0,1 moles de moléculas de AlBr3.
4. El cloruro de calcio se forma a partir de ácido clorhídrico y carbonato de calcio según la siguiente reacción:
2 HCl (l) + CaCO3 (s) CaCl2 (s) + CO2 (g) + H2O (l)
a) Indicar cuál es la relación estequiométrica en gramos para la reacción (buscar los Ar –pesos atómicos– en la tabla periódica).
|
|
2 HCl (l) |
+ |
CaCO3 (s) |
= |
CaCl2 (s) |
+ |
CO2 (g) |
+ |
H2O (l) |
|
Moles |
2 |
|
1 |
|
1 |
|
1 |
|
1 |
|
Partículas |
1,204E+24 |
|
6,020E+23 |
|
6,020E+23 |
|
6,020E+23 |
|
6,020E+23 |
|
Masa |
72,92 |
|
100,09 |
|
110,98 |
|
44,01 |
|
18,02 |
b) Si hacemos reaccionar 300 g del ácido con 500 g de la sal, ¿Cuál es la sustancia que actúa como reactivo limitante?
|
g CaCO3 |
g HCl |
|
|
100,09 |
72,92 |
|
|
500,00 |
364,27 |
No hay… |
O bien,
|
g HCl |
g CaCO3 |
|
|
72,92 |
100,09 |
|
|
300,00 |
411,78 |
Sí hay… |
Cualquiera sea la vía elegida, queda claro que el ÁCIDO CLORHÍDRICO es el reactivo LIMITANTE y el carbonato de calcio es el reactivo en exceso…
c) En función de las cantidades citadas en el punto anterior, ¿Cuántos moles de dióxido de carbono se obtuvieron?
|
g CaCO3 |
moles CO2 |
|
100,09 |
1,0 |
|
411,78 |
4,1 |
O bien,
|
g HCl |
moles CO2 |
|
72,92 |
1,0 |
|
300,00 |
4,1 |
Como sea que lo calculen, se produjeron 4,1 moles de moléculas de CO2.
5. El nombre común del metanol, CH3OH, es alcohol metílico. La mayor parte del metanol se produce comercialmente por la reacción del monóxido de carbono, CO, con hidrógeno gaseoso, a temperatura y presión elevadas. Si 72,0 kilogramos de CO reaccionaron con 5,50 kilogramos de H2, efectúa los cálculos necesarios con base en la ecuación siguiente:
CO (g) + 2 H2 (g) CH3OH (l)
|
|
CO (g) |
+ |
2 H2 (g) |
= |
CH3OH (l) |
|
moles |
1 |
|
2 |
|
1 |
|
partículas |
6,020E+23 |
|
1,204E+24 |
|
6,020E+23 |
|
masa |
28,01 |
|
4,04 |
|
32,05 |
a) ¿Cuál es la sustancia que actúa como reactivo limitante?
|
g CO (g) |
g H2 (g) |
|
|
28,01 |
4,04 |
|
|
72000,00 |
10384,86 |
No hay… |
|
|
10,4 |
kg de H2 |
O bien,
|
g H2 (g) |
g CO (g) |
|
|
4,04 |
28,01 |
|
|
5500,00 |
38132,43 |
Sí hay… |
|
|
38,1 |
kg de CO |
b) ¿Cuántos moles del alcohol se obtuvieron?
|
g CO (g) |
moles CH3OH |
|
28,01 |
1,0 |
|
38132,43 |
1361,4 |
O bien,
|
g H2 (g) |
moles CH3OH |
|
4,04 |
1,0 |
|
5500,00 |
1361,4 |
Por cualquiera de las dos vías, se obtuvieron 1361,4 moles del alcohol.
REACTIVO LIMITANTE (R.L.): aquel reactivo que se consume en su totalidad durante la reacción y que limita la cantidad de producto a obtener, siendo que existe otro que no se consume en su totalidad y del cual sobra un resto sin reaccionar…
REACTIVO EN EXCESO (R.E.): aquel reactivo que NO se consume en su totalidad durante la reacción y del cual sobra un resto sin reaccionar, siendo que existe otro que limita la cantidad de producto a obtener y que no se consume en su totalidad…
ESPECIFICACIONES_TECNICAS_ADQUISICION_DE_REACTIVOS_PARA_EL_DIAGNOSTICO_DEL_COVID_19_2_item
EXPEDIENTE 372008S OBJETO DEL CONTRATO SUMINISTRO DE REACTIVOS GENERALES
FICHA TECNICA INSUMOS REACTIVOS Y EQUIPOS LABORATORIO DE SALUD
Tags: amoníaco, ampliamente, reactivo, obtener, utilizado, limitante
- SEDE LEGALE IN CSO ENOTRIA 2 12051ALBA (CN)
- FOOTHILL COLLEGE ADDENDUM TO THE COURSE OUTLINE OF RECORD
- 4 SKELBIAMAS 1ASIS KONKURSAS DĖL PALANGOS MIESTO SAVIVALDYBĖS TARYBOS
- MIGUEL MARIA LISBOA BARÃO E BARONESA DE JAPURÁ
- UNIVERSIDAD DE ESPECIALIDADES ESPÍRITU SANTO FACULTAD DE COMUNICACIÓN SYLLABUS
- 6 DISCURSO DE EMILIO YBARRA EN EL CIRCULO ECUESTRE
- 82 RATA ACE PAPERS REFLECTION INTERNALISING THE PRISON?
- INSTRUCTIONS FOR APPLYING TO ROMA EDUCATION FUND INSTRUKCII ZA
- BONDAD DE AJUSTE E INDEPENDENCIA 1 LOS PORCENTAJES DE
- MODELO RECOGIDA DE INFORMACIÓN VETERINARIA (IMPORTANTE ESCRIBIR CON LETRA
- TEIL 1 WIR BESTIMMEN DIE DICHTE FÜR DIESE
- A TYPICAL LESSON PLAN A TYPICAL LESSON LASTS 45
- HIGIENE DEL PERSONAL PNLPG00300 PÁGINA 5 DE 5 HIGIENE
- MUJER DE MEDIANA EDAD HIPERTENSA CON DOLOR TORÁCICO BRUSCO
- KATEDRA KRIMINALISTIČKIH NAUKA TERMINI ZA KONSULTACIJE U ZIMSKOM SEMESTRU
- VERSIÓN PARA EL ALUMNO PROTOTIPO DE EXAMEN DE CIENCIAS
- COME THE KINGDOM OF YOU “YOUR KINGDOM COME” MIGHT
- KAUNO RAJONO GARLIAVOS SPORTO IR KULTŪROS CENTRO 2016 M
- DRUK NR 83 WARSZAWA 15 GRUDNIA 2011 R SEJM
- CENTRO NACIONAL DE METROLOGÍA D IRECCIÓN DE METROLOGÍA DE
- 10 PROBLEMAS DE LA CORRECCIÓN EN EL ENTRENAMIENTO DE
- BISD 26S205209 MARCH 1980 DECLARATION ON TRADE MEASURES TAKEN
- TYPOTEST – ŘEŠENÍ STATISTIKY NIELSEN UKAZUJÍ 4547 VE
- VIRI ŠPANSKOSLOVENSKI IN SLOVENSKOŠPANSKI MODERNI SLOVAR PRVA IZDAJA CANKARJEVA
- VOCABULARIO BÁSICO RELACIONADO CON EL CUERPO HUMANO SE HA
- 15 Instructions for Creating a File to Upload Inventory
- DECRETO Nº (RA073803) ACUERDO EL EXCMO AYUNTAMIENTO PLENO
- LIST PAPEŽE BENEDIKTA XVI SEMINARISTŮM DRAZÍ SEMINARISTÉ KDYŽ JSEM
- MATSOGI JUNIOŘI A 52KG 1 NARAMA VYZRÁL ALEŠ 2
- PROTOCOL ESTABLISHING THE FISHING RIGHTS AND CONTRIBUTIONS PROVIDED FOR
ŁÓDŹ DNIA …………………………… (IMIĘ I NAZWISKO) …………………………… (ADRES ZAMIESZKANIA)
 APLICACIÓN DE ONDAS DE CHOQUE EXTRACORPÓREAS EN EL TRATAMIENTO
APLICACIÓN DE ONDAS DE CHOQUE EXTRACORPÓREAS EN EL TRATAMIENTOOBČINA SVETI TOMAŽ PRIPRAVA STRATEGIJE IN PROSTORSKEGA REDA NASELJE
 PRZEDSIĘBIORSTWO ENERGETYKI CIEPLNEJ W ROPCZYCACH SP Z OO UL
PRZEDSIĘBIORSTWO ENERGETYKI CIEPLNEJ W ROPCZYCACH SP Z OO UL NAMECLASS USING FACTS TO ANSWER QUESTIONS Q UESTION ?
NAMECLASS USING FACTS TO ANSWER QUESTIONS Q UESTION ?LINKS TO EPA DOCUMENTS FOR WHOLE EFFLUENT TESTING (WET)
CARTÓRIOS EM SÃO LUÍS MUNICÍPIO SÃO LUÍS SERVENTIA 1ª
ANEXO 1 GUÍA DE AUTOEVALUACIÓN DATOS GENERALES MARQUEN CON
THE DISAPPEARING BEAKER 1 DESCRIBE WHAT HAPPENED IN THIS
 EL AYUNTAMIENTO RENUEVA EL SISTEMA DE RIEGO EN LAS
EL AYUNTAMIENTO RENUEVA EL SISTEMA DE RIEGO EN LASGOLEEN & DISTRICT COMMUNITY COUNCIL DEAR NEIGHBOUR HERE WE
 GR 11 PRAKTIESE EKSAMEN VRYSTAAT 2016 3 PUNTE 60
GR 11 PRAKTIESE EKSAMEN VRYSTAAT 2016 3 PUNTE 60 CONVOCATÒRIA CONTRACTE PREDOCTORAL 418701 VINCULAT AL DEPARTAMENT D’ARQUITECTURA DE
CONVOCATÒRIA CONTRACTE PREDOCTORAL 418701 VINCULAT AL DEPARTAMENT D’ARQUITECTURA DESTATE OF CALIFORNIA DEPARTMENT OF RESOURCES RECYCLING AND RECOVERY
 13 PAJUELO TEVES RAMÓN EL LUGAR DE LA UTOPÍA
13 PAJUELO TEVES RAMÓN EL LUGAR DE LA UTOPÍA PHỤ LỤC IV BIỂU MẪU KIỂM TRA VÀ ĐÁNH
PHỤ LỤC IV BIỂU MẪU KIỂM TRA VÀ ĐÁNH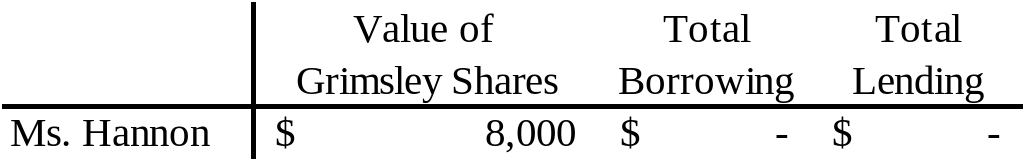 Chapter 15 Capital Structure Basic Concepts 151 a Since
Chapter 15 Capital Structure Basic Concepts 151 a Since SOLICITUD DEPÓSITO DE TESIS DOCTORAL DATOS DEL DE LA
SOLICITUD DEPÓSITO DE TESIS DOCTORAL DATOS DEL DE LASIS ENROLLMENT MENU PATH QUICK GUIDE 3920 WHERE
DEFENSOR DEL PUEBLO ANDALUZ RESIDUOS DE CEBADEROS Y GRANJAS