QUÍMICA 2º BACHILLERATAO CINÉTICA EQUILIBRIO Y ACIDOBASE 1) SE
Hasta Ahora Hemos Estudiado a las Reacciones Químicas3 Lista de Exercícios 02 – Cinética Química Aplicada
6 Cinética Química Algumas Observações Relativas à Determinação da
Academia de Ciencias Matemáticas Físicoquímicas y Naturales de Granada
Cinética Química 1 Considera la Reacción de Orden Cero
Cinética Química abp Expedición a Cusco – Primera Parte
QUÍMICA 2º BACHILLERATAO. Cinética, equilibrio y acido-base.
1) Se preparan 2 disoluciones A y B.
A, se prepara disolviendo 3,2 gr de ácido nítrico (hidroxidodioxidonitrogeno) en un volumen de 500 ml.
B, se prepara disolviendo 1,7 gr de amoníaco (Kb=1,8·10-5) en un volumen de 750 cm3.
Calcula el pH de la disolución A.
Calcula el pH de la disolución B
¿Cuántos ml de A neutralizarán 50 ml de B?
Explica si una disolución de nitrato de amonio tendrá carácter ácido, básico o neutro.
a) HNO3 H+ + NO3 – M=3,4 /63·0,5 = 0,1 n/l
[ ]0 0,1 M 0 0
[ ]f 0 0,1 0,1
pH=-log 0,1 = 1
b) NH3 + H2O NH4 + + OH- M=1,7/17·0,75 = 0,13 n/l
[ ]0 0,13 M 0 0
[ ]eq 0,13(1-) 0,13 0,13
1,8·10-5 = 0,130,130,13(1-) = 0,012 (1,2%)
pOH= -log (0,13 · 0,012) = 2,8 pH= 11,2
c) Va·Na=Vb·Nb Va·0,1 = 50 · 0,13 Va= 65 ml
d) La disolución de NH4NO3 genera 2 iones, NH4+ y NO3-.
El ión NO3- es la base conjugada del HNO3 que por ser un ácido fuerte, su base conjugada tiene carácter débil y su acción es despreciable.
El ión NH4+ es el ácido conjugado del NH3 que por ser una base débil, tendrá un carácter fuerte y generará el siguiente equilibrio:
NH4+ + H2O NH3 + H3O+ lo que dará a la disolución un carácter ácido.
2) El eteno (C2H4). es un gas que se descompone en Hidrógeno y gas acetileno (C2H2) Sabiendo que a 20ºC la Kc=0,22:
a) Formula el equilibrio y calcula el porcentaje de eteno disociado al introducir 0,4 moles de eteno en un recipiente de 2 litros a 20ºC.
b) Calcula la presión parcial de cada gas y la presión total.
c) Calcula Kp a partir de las presiones parciales y comprueba que se cumple la relación entre Kp y Kc.
d) Si al calentar se disocia más porcentaje de eteno, deduce si la reacción es exotérmica o endotérmica.
C2H4 H2 + C2H2
n0 0,4 0 0
neq 0,4(1-) 0,4 0,4
0,2 ·0,2
0,22 = ----------------- = 0,63 (63%)
0,2(1-)
b) P C2H4 =0,4(1-0,63)·0,082·293/2 = 1,78 atmf
P H2 = P C2H2 = 0,4·0,63·0,082·293/2 = 3,03 atmf
c) Kp= 3,03·3,03/1,78 = 5,16
Kp= 0,22(0,082·293)1 = 5,28
d) Si al calentar aumenta es porque el equilibrio se desplaza hacia la derecha contrarrestando el calor que se encuentra a la izquierda luego se trata de una reacción endotérmica.
3) El producto de solubilidad del hidróxido de magnesio es 1,2·10-11 a 25ºC. Comenta si son verdaderas o falsas las siguientes afirmaciones:
a) En 2 litros de disolución puedo disolver 16,5 mg de hidróxido de magnesio aproximadamente.
b) Se disuelve más rápidamente en caliente porque se trata de un proceso exotérmico.
c) En un medio ácido se disolverá más cantidad hidróxido de magnesio.
d) La solubilidad del hidróxido de magnesio disminuirá si disminuyo el volumen.
a) Ks=[Mg2+]·[OH-]2 = s·(2s)2 = 4s3 ; 1,2·10-11 = 4s3 ; s= 1,44·10-4 n/l = 8,3·10-3 g/l
Verdadero, si en 1 litro puedo disolver 8,3 mg, en 2 litros podré disolver 16,5 mg aproximadamente.
b) Falso, se disuelve más rápidamente en caliente porque aumenta la energía de las moléculas y hay más choque eficaces, lo mismo ocurriría si el proceso fuera endotérmico.
c) Verdadero, el medio ácido proporciona iones H+ que neutralizarán parte de los iones OH-. La disminución de los iones OH- afecta al equilibrio Mg(OH)2 Mg2+ + 2OH-
que se desplazará hacia la derecha para contrarrestar según el principio de Le Chatelier haciendo que se disuelva más Mg(OH)2.
d) Falso, la solubilidad es la concentración de la disolución saturada y solo varía con la temperatura.
Cinética Química ies la Magdalena Avilés Asturias la Cinética
Cinetica Química uno de los Modelos que Explican Cómo
Ejercicios Selectividad Zaragoza Cinética Química Junio 2008 Opción
Tags: equilibrio, acidobase, cinética, química, bachilleratao
- PRUEBA DE HABILIDAD PARA SEGUIR INSTRUCCIONES 1 LEE TODAS
- DA PRESENTARE SU CARTA INTESTATA DEL SOGGETTO PROPONENTE SPETTLE
- SUMMARY OF PROPOSED CHANGES TO COLLECTIVE BARGAINING AGREEMENT ARTICLE
- HTTPAPRIMAES XVII CONCURSO DE PRIMAVERA DE MATEMÁTICAS LA RIOJA
- WEST VIRGINIA DEPARTMENT OF TRANSPORTATION DIVISION OF HIGHWAYS CONSULTANT
- REGOLAMENTO DI TIROCINIO APPROVATO DAL CONSIGLIO DEL CORSO DI
- SCH 1 FORM 1 AMENDED BY SR NO 12016
- INTERNATIONAL BIODIVERSITY DAY 2007 BIODIVERSITY AND CLIMATE CHANGE THE
- ALTAR SERVERS ROSTER – JULY TO SEPT 2017 MONTH
- WYZNACZ DZIEDZINĘ WYRAŻENIA WYMIERNEGO I UPROŚĆ JE A) 13X3(3X3+X2)
- 23 Nº TEMA PÁGINAS CALIFICACIÓN 1 CONCEPTOS FUNDAMENTALES DE
- L20 DOORSSHUTTERSHATCHES 490 AUTOMATIC DOORS MANUFACTURER BESAM LIMITED WASHINGTON
- NO ES NECESARIA AUTENTICACIÓN NOTARIAL NI LEGALIZACIÓN CONSULAR CUBA
- DEUTSCH INFOBLATT INFORMATIONSBLATT FÜR DIE ARBEITER AM BAUERNHOF
- LEY 3401 ART 1 ADOPTASE PARA LA PROVINCIA DEL
- EVROPSKO RAČUNSKO SODIŠČE PRILOGAIX AO ŠT24161210 IZJAVA O ODSOTNOSTI
- INTERNATIONAL PLANNED PARENTHOOD FEDERATION JOB DESCRIPTION (IPPF) 4 JOB
- MẪU A1ĐXNV PHIẾU ĐỀ XUẤT NHIỆM VỤ KHOA HỌC
- INFORMACIÓN PARA PRESCRIBIR AMPLIA (IPPA) 1 DENOMINACIÓN DISTINTIVA LONACTENE®
- PROGRAM MINUTOWY 800 900 –PRZYJAZD REPREZENTACJI SZKÓŁ 900930
- WAIKATO BUILDING CONSENTS COMPLIANCE SCHEDULE DETAILS SS 133 –
- GACKO PUČKO OTVORENO UČILIŠTE OTOČAC TRG DRAŽENA BOBINCA 2
- 2021 PETITION FOR FACULTY MEMORIALREPLACEMENT MEMORIAL NO APPLICATION SHOULD
- WWWRECURSOSDIDACTICOSORG 1 D X EL GRÁFICO CALCULE “X” A)
- POINT SOURCE IRRIGATION EMITTERS PROVIDE LOWVOLUME POINTSOURCE EMISSION DEVICES
- 5 TOWN OF WEST BRIDGEWATER BYLAW FEE TRANSMITTAL FORM
- UVESCO CRECE UN 8 HASTA LOS 703 MILLONES DE
- ZAŁĄCZNIK NR 1 DO ZARZĄDZENIA REKTORA UM W LUBLINIE
- GRUPA MUSZKIETERÓW OSTREWKA DZIAŁ INFORMATYKI ELEKTRONICZNY PLIK DOSTAWY WERSJA
- PEDOMAN PENYELENGGARAAN PERINGATAN HARI IBU KE91 TAHUN 2019 A
JOINT HINDU FAMILY LETTER FOR CORPORATE INTERNET BANKING ANDOR
NAME LAB PARTNER SIMPLE PENDULUM OBJECTIVES 1) TO
PAGE 3 OF 3 CITY OF WOODBURY BUSINESS MEETING
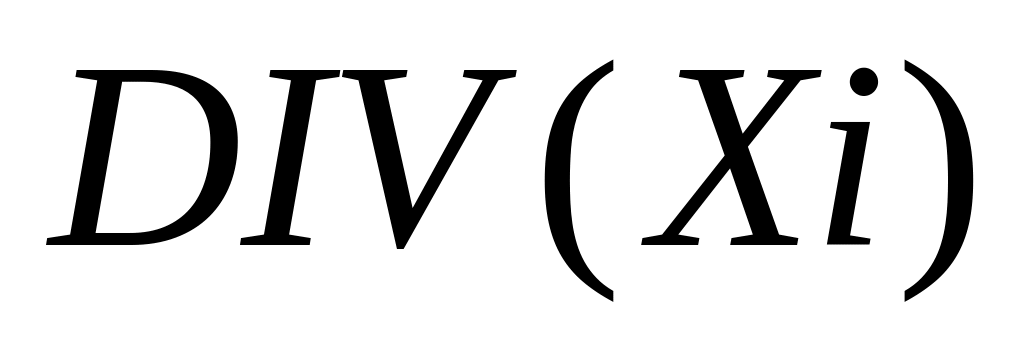 LENGUAJE WHILE EL LENGUAJE WHILE ESTÁ BASADO EN EL
LENGUAJE WHILE EL LENGUAJE WHILE ESTÁ BASADO EN EL VIA ALPINA – PREDSTAVITVENA MAPA FEBRUAR 2014 17 VIA
VIA ALPINA – PREDSTAVITVENA MAPA FEBRUAR 2014 17 VIAMINUTES OF PARK SURGERY PPG MEETING HELD ON MONDAY
PATVIRTINTA PALANGOS LOPŠELIODARŽELIO ŽILVINAS” DIREKTORIAUS 2014 M KOVO 20
 ECOLOGÍA UNIVERSIDAD NACIONAL DE LOMAS DE ZAMORA FACULTAD DE
ECOLOGÍA UNIVERSIDAD NACIONAL DE LOMAS DE ZAMORA FACULTAD DE ANNEX IV ANNEX XVII REPORTING ON ASSET ENCUMBRANCE TABLE
ANNEX IV ANNEX XVII REPORTING ON ASSET ENCUMBRANCE TABLE REGIONAL AIR SERVICES ESTE MEMBRU AL AROPA – ASOCIATIA
REGIONAL AIR SERVICES ESTE MEMBRU AL AROPA – ASOCIATIA MODELO DE SCHMIDT LAS INVESTIGACIONES DE SCHMIDT EXPLICAN
MODELO DE SCHMIDT LAS INVESTIGACIONES DE SCHMIDT EXPLICAN!doctype Html html Langptbr head meta Charsetutf8 meta Namerobots
IN RECENT YEARS AN INCREASE IN VECTORBORNE DISEASE ACTIVITY
CENTRAL CONNECTICUT STATE UNIVERSITY NEW BRITAIN CT 060504010 REQUEST
 SERTI PROJECT SOFTWARE PLAN 342003 SERTI SUSANNA BLOMQVIST ANTTI
SERTI PROJECT SOFTWARE PLAN 342003 SERTI SUSANNA BLOMQVIST ANTTITHE 30MINUTE WATER WORKOUT SPENDING A LITTLE DOWNTIME AT
GPOR00506742016 ZARZĄDZENIE NR 6742016 PREZYDENTA MIASTA STOŁECZNEGO WARSZAWY Z
 FENOLOGÍA DE LA FLORACIÓN EN TOMATE CULTIVADO Y ESPECIES
FENOLOGÍA DE LA FLORACIÓN EN TOMATE CULTIVADO Y ESPECIES bolcsodei-beiratkozas-2021-2022nevelesi-evre-1617012604-195
bolcsodei-beiratkozas-2021-2022nevelesi-evre-1617012604-195 SLOVENSKÁ POŠTA A S POSTSERVIS SEKCIA LOGISTIKY BOJNICKÁ 14
SLOVENSKÁ POŠTA A S POSTSERVIS SEKCIA LOGISTIKY BOJNICKÁ 14