7 “FRACCIONAMIENTO FITOQUIMICO DEL CONTENIDO DE METABOLITOS SECUNDARIOS EN
7 “FRACCIONAMIENTO FITOQUIMICO DEL CONTENIDO DE METABOLITOS SECUNDARIOS EN
UNIVERSIDAD NACIONAL AGRARIA DE LA SELVA
“FRACCIONAMIENTO FITOQUIMICO DEL CONTENIDO DE METABOLITOS SECUNDARIOS EN HOJAS DE LA PLANTA MEDICINAL “OJE” (Ficus insípida)”
Pedro Vejarano Jara1
Guerrero Vejarano Tania2
Universidad Nacional Agraria de la Selva
Tingo Maria
1 .-
Ing° Químico, M.S.c. [email protected]
.-
Ing° Químico, M.S.c. [email protected]
2.- Ing° Químico, M.Sc.
RESUMEN
En el presente trabajo de investigación se realizo el fraccionamiento fitoquímico del contenido de metabolitos secundarios en hojas de la planta medicinal “Ojé” (Ficus insípida). Esta planta es muy usada en la Región del Alto Huallaga por sus propiedades curativas, la resina o látex tiene efecto antihelmíntico (para todo tipo de parásitos intestinales), además se usa como hematopoyético, depurativo de la sangre, anemia, dolor de muelas, fiebre, helmintiasis, leishmaniasis o uta, mordedura de serpiente, picadura de hormiga y raya , reumatismo. El látex es empleado contra la mordedura de peces, al fruto se le atribuye propiedades afrodiciacas y mejoradoras de la memoria. La ficina (enzima proteolítica) que se obtiene del látex de ojé se emplea para la elaboración de productos farmacéuticos por sus propiedades antihelmínticas, además se usa como ablandador de carne y modificador de proteínas y como clarificador de cerveza, etc. La especie fue ubicada y recolectada en el mes de setiembre del 2010, aproximadamente a las 7 y 30 am, en el lugar denominado Vivero de la Facultad de Recursos Naturales Renovables de la Universidad Nacional Agraria de la Selva de Tingo Maria, a una altura de 660 m.s.n.m. Las hojas fueron secadas a temperatura ambiente y posteriormente molidas. Con 20 g de polvo seco se realizaron dos maceraciones una acuosa y otra etanol-agua (70:30), después se realizó el fraccionamiento fitoquímico siguiendo la metodología citada por Martínez, A. (1991). El fraccionamiento fitoquímico se realizó para identificar cualitativamente los metabolitos secundarios siguientes: aminoácidos (AA), compuestos fenolitos (CF), taninos (TA), flavonoides (FL), triterpenoides y/o esteroides (TE), quinonas (QU), cardiotónicos (CA), alcaloides (AL) y leucoantocianinas (LE). A los resultados se les dio la siguiente asignación: negativo (-), dudoso (+/-), positivo (+), francamente positivo (++) y no determinado (ND). Considerando la mencionada asignación y dependiendo del tipo de solvente utilizado el reporte de los resultados sobre el contenido de metabolitos secundarios fue como sigue: En extracción acuosa: CF(++), LE(++) y FL(++). Extracción con ácido clorhídrico diluido: en la fracción C en medio acido AL (+), en la fracción E en medio básico Al (+/-); en la extracción alcohólica: fracción A en medio acuoso caliente FL (++) y LE (++), en medio acuoso frio CF (++) y TA (++); en la fracción B clorofórmica FL (+/-) y TE (+/-); en la fracción C en medio acido AL (+/-); en la fracción E en medio ligeramente acido CF (+/-) y en medio acido FL (++) y LE (+/-).
Palabras claves: fraccionamiento fitoquímico, oje, Ficus insípida, metabolitos secundarios, compuestos fenólicos, taninos, flavonoides, triterpenos, esteroides, leucoantocianinas,
INTRODUCCIÓN
Las plantas medicinales vienen siendo utilizadas por el hombre desde tiempos remotos como medicamentos en tratamientos para curar sus enfermedades, asimismo una gran variedad de plantas son utilizadas por la industria de fármacos para fabricar medicamentos. Después de muchos años de uso de los fármacos sintéticos, cuyo uso es discutible, por cuanto estudios toxicológicos revelan que pueden provocar trastornos en la salud de los consumidores por los efectos secundarios, así como efectos cancerigenos, por lo que su uso esta normado legalmente. De allí que en la actualidad exista la tendencia hacia el uso de medicamentos de origen natural, es decir el consumo de plantas medicinales como fuente de medicamento para la cura de diversas enfermedades.
Existen muchas plantas, que si bien es cierto han tenido buenos resultados en el tratamiento de enfermedades, pero en algunos casos por falta de información técnica o científica, el uso inadecuado puede causar trastornos en la salud, tal es el caso de la planta medicinal conocida como Ojé (Ficus insípida) cuyos ensayos científicos han demostrado que el látex o resina tiene efecto antihelmíntico (para todo tipo de paracitos intestinales), además se usa como hematopoyético, depurativo de la sangre, anemia, dolor de muelas, fiebre, helmintiasis, leishmaniasis o uta, mordedura de serpiente, picadura de hormiga y raya, reumatismo. El látex es empleado contra la mordedura de peces, al fruto se le atribuye propiedades afrodisiacas y mejoradoras de la memoria. La ficina (enzima proteolítica) que se obtiene del látex de ojé se emplea para elaborar productos farmacéuticos por sus propiedades antihelmínticas, además se usa como ablandador de carne y modificador de proteínas y como clarificador de cerveza. Esta planta crece de manera silvestre y cultivada en la amazonia alta y baja cerca de los ríos de la Selva Peruana y de otros países tropicales. Sin embargo a pesar de tan importantes propiedades no se ha encontrado en la bibliografía local estudios acerca de la composición fitoquímica de esta planta, por lo que cabe la necesidad de hacer un estudio fitoquímica de las hojas de Ojé, para determinar que metabolitos secundarios están presentes en la planta medicinal Ojé (Ficus insípida), para su posterior propagación y uso adecuado en la región.
REVISION DE LITERATURA.
Rosa A. Giove Nakawa (1996), manifiesta que uno de los antihelmínticos vegetales más estudiados es el OJÉ (Ficus insípida, antihelmíntica o macrocyses, fam. moraceae). La eficacia antihelmíntica debida a sus componentes ficina, filoxantina, B-amirina, lupeol, lavandulol, phyllantel, 18 eloxanthina, filantelol, 18 doxantina ha sido probada para todo tipo de parásitos intestinales.
Rodolfo TAFUR Zevallos (2010), El OQE u OJE es un árbol de 25 mts de altura aproximadamente, tronco recto y abundante látex de color blanco-lechoso. Sus hojas son enteras y tienen estipulas terminales. Posee flores bisexuales y un fruto globoso de unos 2 a 3 cm de diámetro con semillas pequeñas y abundantes. El látex blanquecino que produce la corteza del ojé tiene múltiples propiedades: se le utiliza como purgante, antihelmíntico, antirreumático, hematopoyético, depurativo de la sangre y para el dolor de muelas, picadura de hormiga, mordedura de serpiente y contra la temible” uta” (enfermedad de la selva). Las hojas de esta especie se utilizan como antieméticas, antipiréticas, febrífugas y antianémicas. Los frutos son un buen mnemónico, es decir, estimulan la memoria.
MATERIALES Y METODOS
Análisis fitoquímico preliminar de muestras vegetales
Domínguez (1973) reporta dos métodos para la extracción y análisis de algunos compuestos químicos como: alcaloides, glicósidos cardiotónicos, esteroles, triterpenos, saponinas, flavonoides, taninos y fenoles; en plantas medicinales. Según Wall et al (1954), citado por Domínguez (1973) el material vegetal seco y molido se somete a una extracción con etanol al 95% en caliente, luego se filtra en frío y se completa a un volumen de 100 ml con agua después se divide en dos partes A 25 ml y B 75 ml. En la solución A se investigan las saponinas por medio de una prueba histológica según Griffing et al (1968) citado por Domínguez (1973). La solución B también se divide en dos porciones, en una de ellas se analizan los flavonoides por medio de reacciones cualitativas, la otra porción de esta solución se divide en cuatro partes, en la primera se investigan los alcaloides, en la segunda taninos, en la tercera fenoles hidrosolubles, según Wall et al (1954) y Galindo et al (1989) y en la cuarta se analizan triterpenos por métodos cualitativos. Para Cain et al (1961), citado por Domínguez (1973), el material seco y molido se somete a extracción con metanol en soxhlet, el metanol se evapora y el residuo rojo-café semisólido se usa para analizar alcaloides, flavonoides, saponinas, esteroides y triterpenos.
METODOLOGIA EXPERIMENTAL
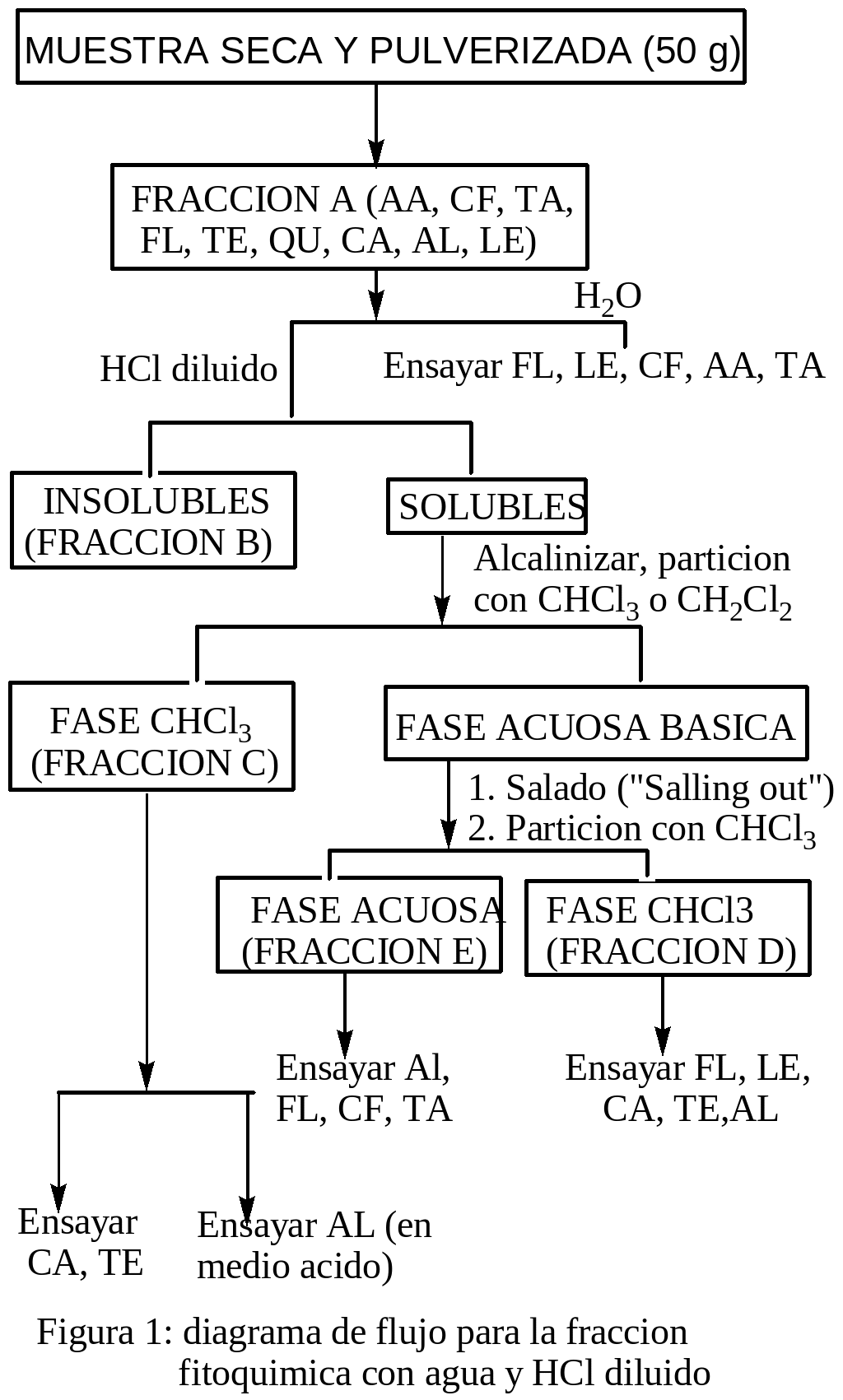
El fraccionamiento fitoquímico de las hojas de las plantas de oje, se realizó siguiendo el método citado por Alejandro Martínez 1991 ( ver las figuras del 1 al 5), según estos diagramas de flujo, en el primer caso, 20 g de muestra seca y pulverizada (FRACCION A: AA, CF, TA, FL, TE, QU, CA, AL, LE) fueron macerados con agua por 24 horas, con el filtrado se hizo los ensayos de: FL, LE, CF, AA y TA. El residuo fue macerado con HCl diluido por 24 horas, el residuo constituye la FRACCION B y con el filtrado se prosiguió según las indicaciones del diagrama de la figura 1, obteniéndose las FRACCIONES: C (CA, TE Y AL), D (FL, LE, CA, TE, AL), E (AL, FL, CF, TA). Para el reporte se tuvo en cuenta la simbología convencional y significado según como se indica en los cuadros siguientes:
CUADRO 1. Asignación a los resultados
________________________
Resultado Asignación
________________________
Negativo -
Dudoso +/-
Positivo +
Fran. Posi. ++
No determi. ND
___________________________
CUADRO 2.- Convensiones para representar a los metabolitos secundarios
________________________________________
Convenciones
____________________________________
Aminoácidos AA
Comp. Feno. CF
Taninos TA
Flavonoides FL
Triter/Esteroi. TE
Quinonas QU
Cardiotónicos CA
Alcaloides AL
Leucoantocianinas. LE
_________________________________________
En el segundo caso, 20 g de muestra seca y pulverizada FRACCION A, fueron macerados con etanol al 95 % por 24 horas, después fue sometido a reflujo por una hora y finalmente fue filtrado, siguiendo las indicaciones de los diagramas 2, 3, 4 y 5 correspondientes a las figuras 2, 3, 4 y 5 respectivamente, los resultados de los ensayos se reportan en el cuadro 2 adjunto, con la simbología convencional y asignación respectiva de acuerdo a lo que se indica en el cuadro anterior, y cuyo procedimiento es el que sigue:
OBTENCION Y ANALISIS DE LA FRACCION A: Cincuenta gramos de la muestra seca y pulverizada fueron macerados con etanol 95 %, por 24 horas, después se sometió a reflujo por una hora y se filtro en caliente. El residuo fue lavado con alcohol y adicionado al filtrado principal, el residuo fue desechado y el filtrado principal conjuntamente con los lavados constituyen la FRACCION A. Con un mililitro de la fracción A se hicieron los ensayos de AA y Cuarenta mililitros pasan a ser la FRACCION A RESIDUAL, el resto fueron evaporados hasta sequedad con calentamiento no mayor a 50° C, después fueron disueltos con 20 ml de agua caliente y filtrados, el residuo fue desechado y con 10 ml de el filtrado acuoso caliente se hizo los ensayos de: FL y LE; diez mililitros de la muestra anterior fueron filtrados en frió con el que se hizo los ensayos de: CF y TA, el residuo fue desechado.
ANALISIS DE LAS FRACCIONES A RESIDUAL Y B: La fracción A residual se llevo a sequedad, después se disolvió con 30 ml de HCl al 5 %, fueron calentados a 60° C por 15 minutos y después filtrados en caliente (FILTRADO ACUOSO ÁCIDO I), el residuo insoluble se lavo con 20 ml de HCl al 5 % y después se filtro, el filtrado se adiciona al filtrado del acápite anterior (FILTRADO ACUOSO ÁCIDO I). El residuo del acápite dos se disolvió con 30 ml de cloroformo, después se deshidrató con Na2SO4 anhidro y luego se filtró. El residuo se desecho y el filtrado fue la FRACCIÓN B con la cual se ensayó: TE, CA, QU, FL.
OBTENCION Y ANALISIS DE LA FRACCION C: El filtrado ACUOSO ÁCIDO I se alcalinizó con NH4OH cc. (pH 10-11), después se extrajo dos veces con 15 ml de cloroformo. La fase acuosa básica se guardó para obtener las fracciones D y E. La fase clorofórmica se lavó con 10 ml de agua cuyo lavado se adiciona a la fase acuosa anterior, y la fase orgánica se deshidrató con Na2SO4 anhidro y después se filtró. El residuo se desechó y el filtrado fue la Fracción C. Con 5 ml de la Fracción C se ensayó: CA y TE. El resto se llevó a sequedad y después se disolvió con 5 ml de HCl al 5 % se calentó y luego se filtró. Con el filtrado se ensayó AL, y el residuo se desechó.
OBTENCION Y ANALISIS DE LAS FRACCIONES D Y E: La fase acuosa básica del análisis anterior se mezcló con una solución salina semisaturada de NaCl y después se extrajo dos veces con 15 ml de cloroformo. La fase acuosa fue la FRACCIÓN E. La fase orgánica se lavó con 20 ml de solución semisaturada de NaCl, la fase acuosa se adicionó a la FRACCIÓN E. La fase orgánica se deshidrató con Na2SO4 anhidro y después fue filtrada, el residuo se desechó y el filtrado fue la FRACCIÓN D, la cual se dividió en tres porciones iguales de 5 ml c/u: D1, D2 y D3, se les llevó a sequedad. La porción D1 se disolvió en 4 ml de etanol y se ensayó: FL, CA, LE. La porción D2 se disolvió en 1 ml de cloroformo y se ensayó: TE. La porción D3 se disolvió con 5 ml de HCl 1% y se ensayó: AL. La fracción E del acápite dos, se neutralizó con HCl y se ensayó: FL, LE, Al (en medio ácido), CF (pH ligeramente ácido) y TA (pH neutro).
Los ensayos para la identificación cualitativa de los metabolitos secundarios presentes en las fracciones A-E de los extractos de las hojas de la planta medicinal oje se realizó de acuerdo a las indicaciones de Martínez (1991), que a continuación se detalla: ENSAYO DE SHINODA PARA FLAVONOIDES Y OTRAS SUSTANCIAS CON EL NUCLEO BENZOPIRONA: a un ml de solución en un tubo de ensayo limpio, se le agregó unas limaduras de magnesio, después se le agregó por las paredes del tubo gotas de HCl concentrado, los resultados fueron positivos y/o negativos de acuerdo a la aparición de los colores: naranja a violeta es prueba positiva para la presencia flavonoides. ENSAYO DE ROSENHEIM (PARA LEUCOANTOCIANIDINAS): a un ml de solución acuosa en un tubo de ensayo limpio, se añadió 0.5 ml de HCl concentrado, fue mezclado y calentado durante 10 minutos a 100°C y después enfriado y fue trasvasado a otro tubo de ensayo al cual se le agregó 0.4 ml de alcohol amilico y mezclados y se dejó reposar hasta la aparición de dos fases. La prueba se consideró positiva si aparecía la coloración en la fase amílica que vaya desde el carmesí oscuro al rosado débil. ENSAYO DEL FeCl3 (PARA COMPUESTOS CON HIDROXILOS FENOLICOS): a 1.0 ml de solución acuosa o alcohólica en un tubo de ensayo limpio, se le añadió 1 gota de FeCl3 al 1% alcohólico, se mezcló. La aparición de coloraciones: violeta, verdes, azules u oscuras se consideró prueba positiva. ENSAYO DE GELATINA-SAL (PARA TANINOS): a 1.0 ml de solución acuosa neutra en un tubo de ensayo limpio, se le añadió 1.0 ml de solución de gelatina-sal. La formación de un precipitado se consideró prueba positiva. ENSAYO DE LIEBERMANN-BURCHARD (PARA TRITERPENOIDES Y/O ESTEROIDES CON GRUPOS DIENO CONJUGADOS REALES O POTENCIALES): a 0.5 ml de solución clorofórmica anhidra en un tubo de ensayo limpio y seco, se le añadió 0.5 ml de Anhídrido acético, después se le añadió por las paredes del tubo, una gota de ácido sulfúrico concentrado. Se consideró positiva la prueba cuando aparecían coloraciones violeta, verde o azul. ENSAYOS PARA ALCALOIDES: a 0.5 ml de solución acuosa ácida en tubo de ensayo limpio, se le añadió una 1 gota del reactivo de Mayer, se consideró prueba positiva cuando aparecen precipitados y/o turbidez en la solución. ENSAYO DE NINHIDRINA (PARA AMINOACIDOS): Se colocó 1 gota de solución, en una tirilla de papel filtro, fue secado y después se añadió 1 gota de reactivo de ninhidrina (Solución al 0.002% en alcohol), después se calentó en una plancha a 105° C. La aparición de coloraciones violeta, azul o rosada se consideró prueba positiva. El proceso experimental se desarrollo de acuerdo a los diagramas de las figuras: 1, 2, 3, 4 y 5:
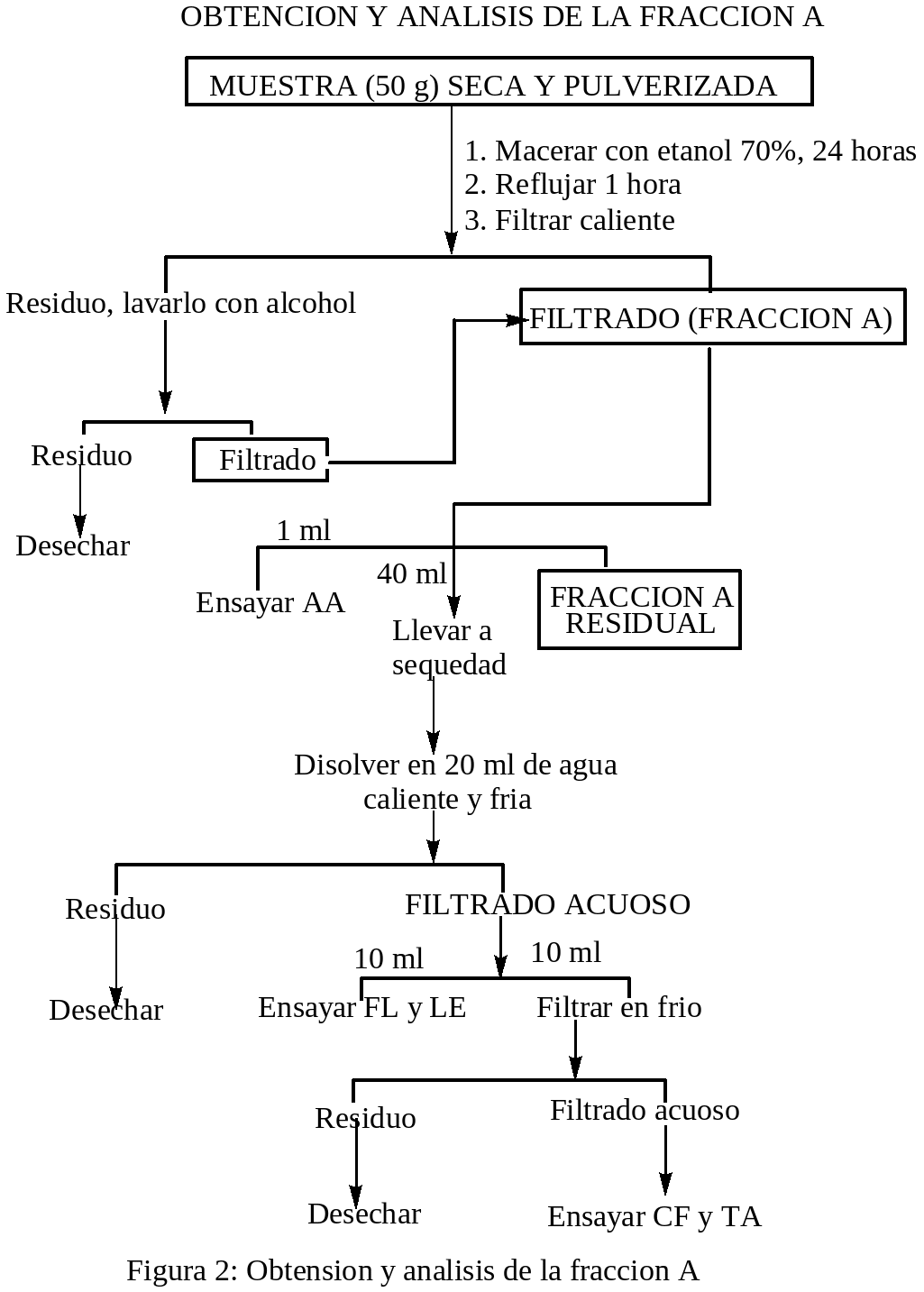
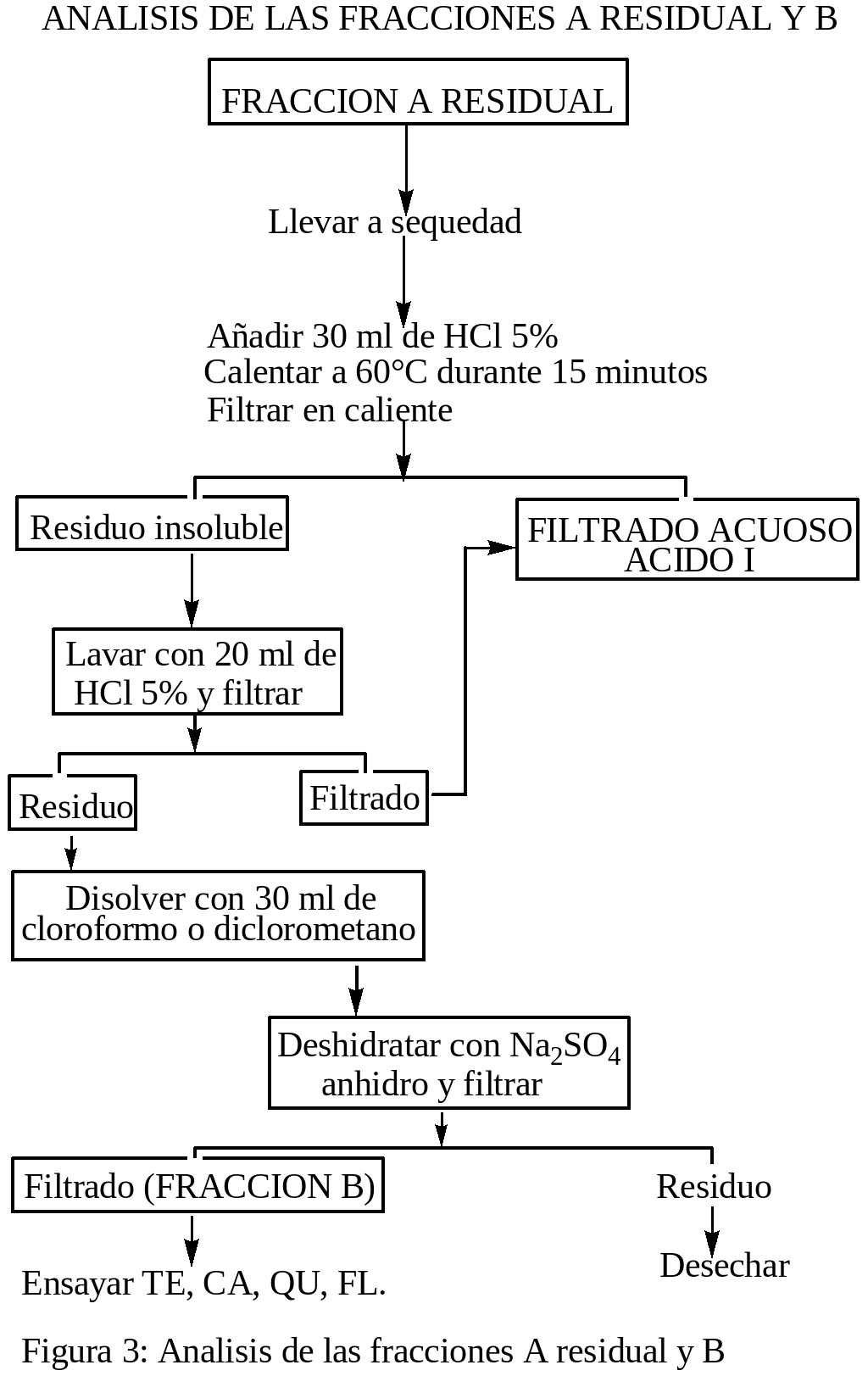
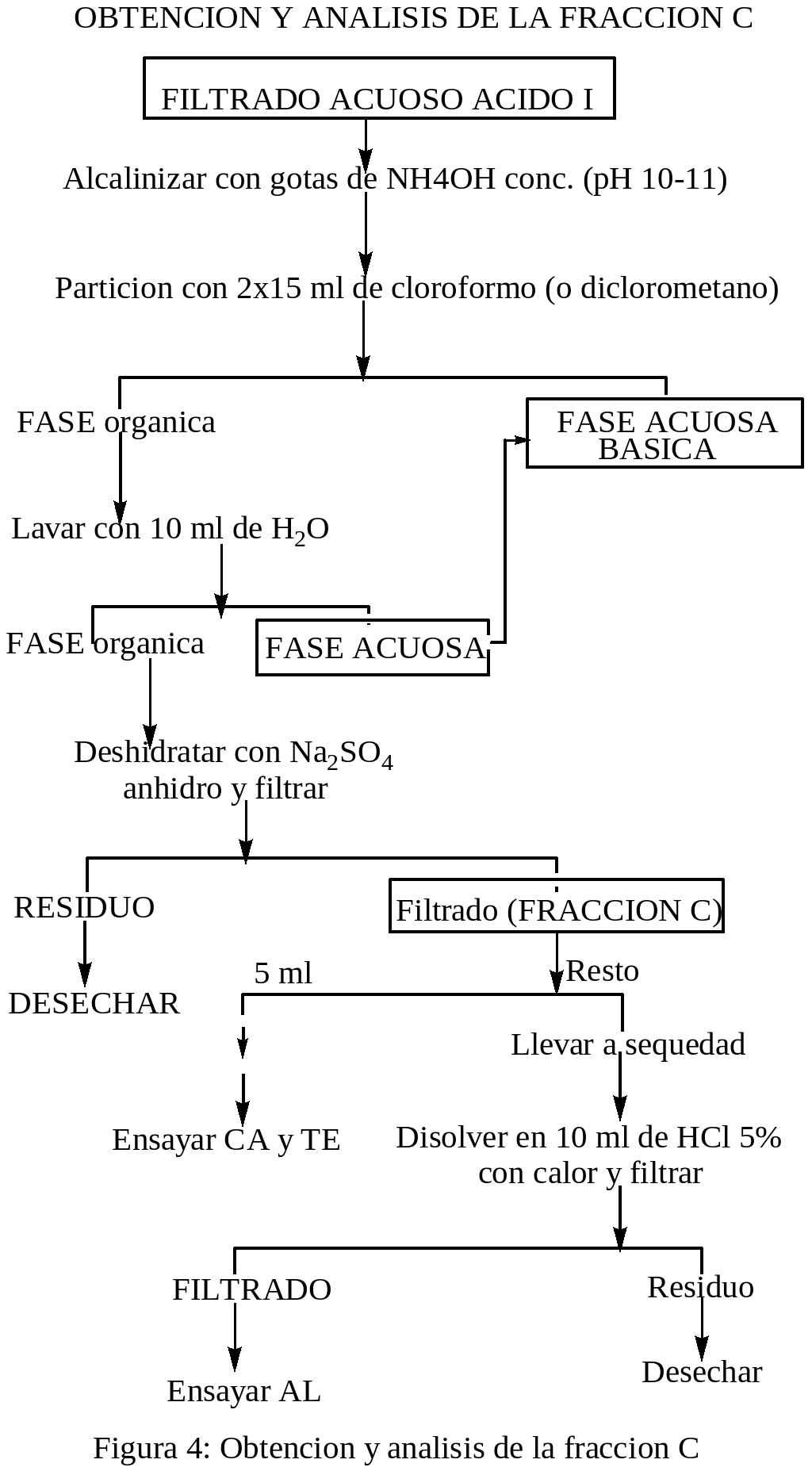
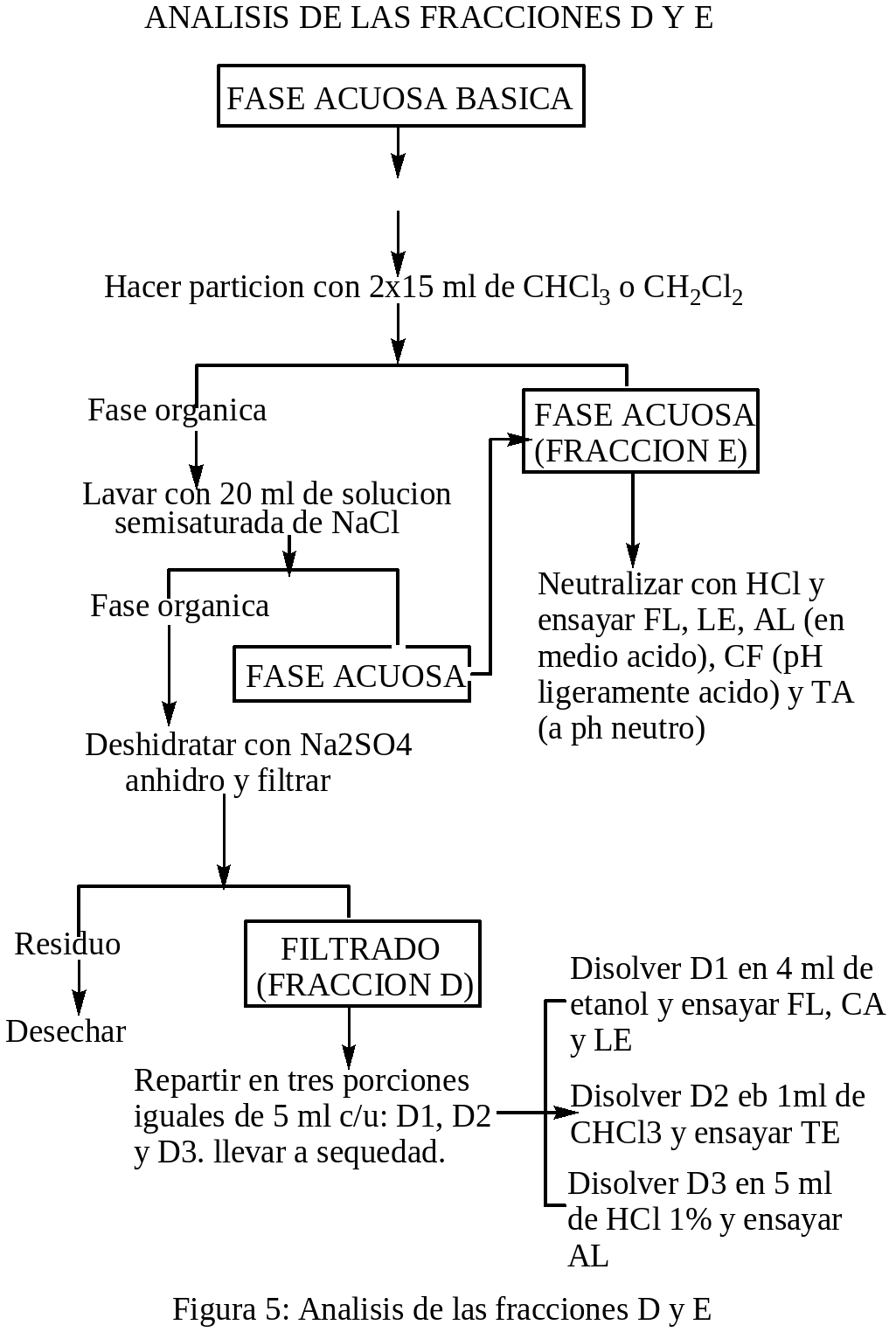
RESULTADOS y DISCUSIONES
El fraccionamiento fitoquimico de los metabolitos secundarios presentes en las hojas de la planta medicinal “Oje” se realizó utilizando dos tipos de solventes: agua y etanol al 95% de acuerdo a la metodología citada por Martínez, A. (1991). Para el efecto las hojas de la droga en estudio fueron recolectadas a tempranas horas de la mañana, después se sometió a secado a condiciones ambientales durante cinco días, después se sometió a secado en estufa a 50 ºC hasta peso constante, se enfrió y se sometió a molienda, la droga finamente molida fue sometida a maceración con cada una de los solventes mencionados por 24 horas, además el residuo del extracto acuoso fue sometido a maceración con agua acida por 24 horas, obteniéndose los extractos: acuoso, acuoso ácido y etanólico. Cada uno de los extractos se sometieron a la respectiva marcha fitoquimica para identificar los diferentes metabolitos secundarios cuyos resultados se puede observar en el Cuadro 3. Los cuales se encuentran justificados según como se indica:
Compuestos fenólicos (CF)
En el cuadro de resultados se puede observar la presencia de compuestos fenolicos francamente positivo por la asignación de dos cruces (++) tanto en los extractos acuosos como en la fracción A (medio acuoso frio) del extracto etanolico y una presencia por confirmar (+/-) en la fracción E (ligeramente ácida) del extracto etanolico. Estos resultados se deben a la intensidad del color azul en la prueba realizada con la solución de cloruro férrico, según lo manifestado por Wall et al (1954). Los fenoles o compuestos fenólicos son compuestos orgánicos en cuyas estructuras moleculares contienen al menos un grupo fenol, un anillo aromático unido a, al menos un grupo funcional. En general son sintetizados por una de dos vías biosintéticas: la vía del ácido shikímico o la vía del ácido malónico (o por las dos, por ejemplo los flavonoides). Los compuestos fenólicos de las plantas son un grupo heterogéneo de productos con más de 10.000 compuestos. Algunos son solubles en solventes orgánicos, otros son glucósidos o ácidos carboxílicos y por lo tanto solubles en agua, y otros son polímeros muy grandes e insolubles. Este grupo juega una variedad muy heterogénea de roles en las plantas, roles que son atribuidos en general a los productos secundarios de las plantas: muchos son productos de defensa ante herbívoros y patógenos, otros proveen soporte mecánico a la planta, otros atraen polinizadores o dispersores de frutos, algunos de ellos absorben la radiación ultravioleta, o actúan como agentes alelopáticos, (por ejemplo reducen el crecimiento de plantas competidoras que estén cerca) Taiz, Lincoln y Eduardo Zeiger (2006).
Taninos (TA)
En el cuadro de resultados se puede observar la presencia de taninos por la asignación de dos cruces (++) francamente positiva solamente en la fracción A (medio acuoso frio) del extracto etanolico. Estos resultados se deben a la formación de un precipitado en la reacción del extracto con la solución de gelatina–sal, según como manifiesta Wall et al (1954). Químicamente los taninos son metabolitos secundarios de las plantas, fenólicos, no nitrogenados, solubles en agua o alcohol-agua y no en alcohol ni solventes orgánicos. Los taninos se utilizan en el curtido porque reaccionan con las proteínas de colágeno presentes en las pieles de los animales, uniéndolas entre sí, de esta forma aumenta la resistencia de la piel al calor, a la putrefacción por agua, y al ataque por microbios. (Butler, L. G. 1989).
Flavonoides (FL)
En el cuadro de resultados se puede observar la presencia de flavonoides francamente positivo por la asignación de dos cruces (++) tanto en los extractos acuosos como en la fracción A (medio acuoso caliente) y fracción E (medio ácido) del extracto etanolico y una presencia por confirmar (+/-) en la fracción B (medio clorofórmico) del extracto etanolico. Estos resultados se deben a la intensidad del color violeta bien definido como producto de la reacción del extracto etanólico con ácido clorhídrico en presencia de magnesio según lo reportado por Caín et al (1961). Flavonoide (del latín flavus, "amarillo"). Son sintetizados a partir de una molécula de fenilalanina y 3 de malonil-CoA, a través de lo que se conoce como "vía biosintética de los flavonoides", cuyo producto, la estructura base, se cicla gracias a una enzima isomerasa. La estructura base, un esqueleto C6-C3-C6, puede sufrir posteriormente muchas modificaciones y adiciones de grupos funcionales, por lo que los flavonoides son una familia muy diversa de compuestos, aunque todos los productos finales se caracterizan por ser polifenólicos y solubles en agua. Los flavonoides que conservan su esqueleto pueden clasificarse, según las isomerizaciones y los grupos funcionales que les son adicionados, en 6 clases principales: las chalconas, las flavonas, los flavonoles, los flavandioles, las antocianinas, y los taninos condensados, más una séptima clase, las auronas, tenidas en cuenta por algunos autores por estar presentes en una cantidad considerable de plantas. También el esqueleto puede sufrir modificaciones, convirtiéndose entonces en el esqueleto de los isoflavonoides o el de los neoflavonoides, que por lo tanto también son derivados de los flavonoides
Triterpenoides y/o esteroides (TE)
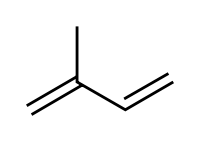
En el cuadro de resultados se puede observar la presencia de compuestos triterpenoides y/o esteroides francamente positivo por la asignación de dos cruces (++) solamente en la fracción B (medio clorofórmico) del extracto etanolico. Estos resultados se deben a la intensidad del color violeta en la reacción del, extracto en un medio clorofórmico, con anhídrido acético y gotas de acido sulfúrico concentrado, según como reporta Galindo et al (1989). Los triterpenoides son compuestos que tienen una estructura base el triterpeno formada por 30 carbonos. Son por lo general generados por la unión cabeza-cabeza de dos cadenas de 15 carbonos, cada una de ellas formada por unidades de isopreno unidas cabeza-cola. Esta clase de moléculas incluye a los brassinoesteroides, componentes de la membrana que son fitoesteroles, algunas fitoalexinas, varias toxinas y "feeding deterrents", y componentes de las ceras de la superficie de las plantas, como el ácido oleanólico de las uvas. (Goodwin, T.W. 1971).
isopreno
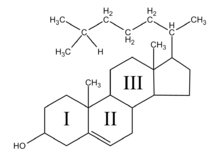
Los esteroides son derivados del núcleo del ciclopentanoperhidrofenantreno o esterano que se compone de carbono e hidrógeno formando cuatro anillos fusionados, tres hexagonales y uno pentagonal; posee 17 átomos de carbono. En los esteroides esta estructura básica se modifica por adición de diversos grupos funcionales, como carbonilos e hidroxilos (hidrófilos) o cadenas hidrocarbonadas (hidrófobas). (Devlin 2004).
Molécula de esterano o Colesterol, el precursor de
ciclopentano-perhidro-fenantreno muchos otros esteroides
Alcaloides (AL)
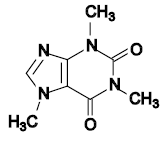
En el cuadro de resultados se puede observar la presencia de alcaloides por: el resultado positivo con la asignación de una cruz (+) en la fracción C (medio clorofórmico ácido) y por confirmar (+/-) en la fracción E (medio básico), ambos con el extracto acuoso ácido. Asimismo la presencia de alcaloides por confirmar (+/-) en la fracción C (medio clorofórmico) del extracto etanolico. Estos resultados se deben al precipitado formado en la prueba del respectivo extracto con el reactivo de Dragenford, según como manifiesta Caín et al (1961). Las estructuras químicas de los alcaloides son variadas. Se considera que un alcaloide es, por definición, un compuesto químico que posee un nitrógeno heterocíclico procedente del metabolismo de aminoácidos, (Robinson T. 1981). Ejemplos conocidos son la cocaína, la morfina, la atropina, la colchicina, la quinina, cafeína, la estricnina, la nicotina, etc.
cafeína
Leucoantocianidinas (LE)
En el cuadro de resultados se puede observar la presencia de compuestos leucoantocianidinas francamente positivo por la asignación de dos cruces (++) tanto en los extractos acuosos, como en la fracción A (medio acuoso caliente) de los extractos etanolicos, así mismo por confirmar (+/-) en la fracción E (medio ácido) de los extractos etanolicos; por el color carmesí que aparece en la fase amílica como resultado del proceso de identificación, según como manifiesta Martínez (1991). Leucoantocianidinas: Son derivados de la dihidroxi-flavonona, también se conocen como antocianos (antocianidinas y antocianósidos): estas sustancias tienen un esqueleto muy parecido al de los catecoles y al de los flavonoides, y son intermediarios entre estas dos categorías de compuestos por su estado de oxidación. Son pigmentos rojos, amarillos y azules de plantas (p.e. Mirtilo). Presentes en altas cantidades en los arándanos y grosellas rojas y en menor cantidad en cerezas, kiwis y ciruelas.
CUADRO 3: Resultados del fraccionamiento fitoquímico de las hojas de la planta medicinal Ojé (Ficus insípida)
Solv. Agua Agua + HCl Etanol al 95%
_____ ____ _____________________________ _________________________________________________________
Frac. A C D E A B C D E
____ ___ ____________ ____ ___ _______________ ____ _______ ____________ __________
Medio H2O CHCl3 CHCL3 H+ CHCl3 HO- EtOH H2O cal. H2O fría CHCl3 CHCl3 H+ EtOH CHCl3 H+ H+ H+/- Neu
AA -
CF ++ - ++ +/-
TA - ++ -
FL ++ - - ++ +/- - ++
TE - - ++ - -
QU
CA
AL + - +/- +/- -
LE ++ - ++ - +/-
Leyenda:
Fracciones Resultado Asignación Convenciones Medio Símbolo
A Negativo - Aminoácidos AA Quinonas QU básico HO-
B Dudoso +/- Comp. Feno. CF Cardiotonicos CA ácido H+
C Positivo + Taninos TA Alcaloides AL lig. ácido H+/-
D Fran. Posi. ++ Flavonoides FL Leucoantocia. LE neutro Neu.
E No determi. ND Triter/Esteroi. TE
CONCLUSIONES
Después de las discusiones se llegó a las siguientes conclusiones:
1.- Se destaca la presencia de compuestos fenólicos, tanto en los extractos acuosos como en los extractos alcohólicos en las fracciones A y A, respectivamente y una presencia no bien definida en la fracción E del extracto alcohólico.
2.- Asimismo se confirma la presencia de taninos, en la fracción A del extracto alcohólico.
3.- Por otro lado tiene un alto contenido de flavonoides en las fracciones: A de la extracción acuosa, A y E de la extracción alcohólica y por confirmar en la fracción B de la extracción alcohólica
4.- La presencia de triterpenos y/o esteroides en la fracción B de los extractos alcohólicos, es significativa.
5.- En cuanto a alcaloides, resulto positivo en la fracción C de la extracción acuosa acida y por confirmar en las fracciones: E de la extracción acuosa ácida y C de la extracción alcohólica.
6.- En cuanto a leucoantocianidinas se nota una presencia significativa en los extractos acuosos y fracción A de la extracción alcohólica y por confirmar en la fracción E de la extracción alcohólica.
7.- No se detectaron aminoácidos
8.- No se realizaron las pruebas de identificación de los metabolitos secundarios denominados quinonas y cardiotónicos.
RECOMENDACIONES
De acuerdo a los resultados y las conclusiones se recomienda:
1.- Realizar ensayos para el aislamiento y elucidación de los metabolitos secundarios denominados compuestos fenólicos mediante extractos acuosos y/o hidroalcoholicos.
2.- Realizar ensayos para el aislamiento y elucidación de taninos mediante solventes acuosos y/o hidroalcoholicos.
3.- Realizar ensayos para el aislamiento y elucidación de los metabolitos secundarios denominados triterpenos y/o esteroides mediante el solvente hidroalcoholico.
4.- Realizar trabajos de investigación para el aislamiento y elucidación de los metabolitos secundarios denominados leucoantocianidinas con solventes acuosos.
5.- Realizar pruebas para la confirmación de la presencia de los metabolitos secundarios denominados flavonoides.
6.- Realizar ensayos para la identificación de alcaloides mediante el uso de los reactivos Dragendorff, Mayer, Valser y Reineckato de amonio.
7.- Realizar pruebas de identificación de los metabolitos secundarios denominados quinonas y cardiotónicos.
REFERENCIAS
Butler, L. G. 1989. Effects of condensed tannin on animal nutrition. En: RW Hemingway y JJ Carchesy (editores). Chemistry and significance of condensed tannins. Plenum, Nueva York. pp. 391-402
Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
Domínguez, X. 1973-1979. métodos de investigación fitoquímica. editorial Limusa, México. 281p.
Giove Nakawa, Rosa A. Revista de Gastroenterología del Perú - Volumen 16, Nº3 1996
Griffin WJ., Owen WR y Perkin JE. Planta Médica 16,75.1968; citado por Domínguez Xorge En: Métodos de investigación fitoquímica, México, Editorial Limusa, 281p
Galindo w., Rosales M., Murgueitio E. y Larrahonda J. 1989 Sustancias antinutricionales en las hojas de guamo, nacedero y matarraton» Livestock Research for Rural Development.
http: //www, Cipav,org,co/lrrd/lrrd1/1/mauricio,Vol. 1, N° 1, 7 p.
Goodwin, T.W. 1971. Aspects of terpenoid chemistry and biochemistry. Academic Press, Londres
Martínez, A. 1991. farmacognosia y fitoquímica experimental. universidad de Antioquia. Medellín
Principios activos de las plantas medicinales: los flavonoides Botanical Online. http://www.elergonomista.com/fitoterapia/flavonoidespropiedades.htm
Robinson T. 1981. The biochemistry of alkaloids. 2ª ed. Springer, Nueva York
Taiz, Lincoln y Eduardo. "Secondary Metabolites and Plant Defense". Zeiger. Plant Physiology, Fourth Edition. Sinauer Associates, Inc. 2006. Capítulo 13
TAFUR Zevallos, Rodolfo. El Oje y el Aguaje, Arboles de la Vida de la Amazonia Peruana 2010
Wall ME, J.Am. Pharm Assoc. Sci. Ed. 43,1. 1954; citado por Domínguez Xorge en Métodos de investigación fitoquímica, México, editorial Limusa, 1973; 281p.
Tags: contenido de, alto contenido, secundarios, fitoquimico, contenido, metabolitos, “fraccionamiento
- EIGNEVALUES AND EIGENVECTORS DEFINITION OF EIGENVECTORS AND EIGENVALUES LET
- the American University in Bulgaria is Committed to a
- Salta al Contigut Logo Generalitat Valenciana Conselleria de
- P ROTOCOLLO GENERALE AL COMUNE DI FERRARA SERVIZIO QUALITA’
- EK7 HİZMET İŞLERİ GENEL ŞARTNAMESİ BİRİNCİ BÖLÜM GENEL
- UPDATED 27112013 CHRISTMAS FAIRS MARKETS AND CAROLS 2013 ALL
- FELD FÜR DAS LICHTBILD FELD FÜR DAS LICHTBILD AN
- HOSSZÚPÁLYI NAGYKÖZSÉG ÖNKORMÁNYZAT KÉPVISELŐTESTÜLETÉNEK 182007 (XI 29) R
- VOLUNTEER COORDINATOR JOB DESCRIPTION (SAMPLE ONLY) THE VOLUNTEER COORDINATOR
- AMOR LA NOCHE HA SIDO LARGA Y LLENA DE
- CRNRDC34 PAGE 3 WIPO CRNRDC34 ORIGINAL ENGLISH DATE DECEMBER
- ZESPÓŁ SZKÓŁ NR 9 IM ROMUALDA TRAUGUTTA W KOSZALINIE
- HISTORIAN HAVINAA JOULUISESSA BERLIINISSÄ BERLIINI SAKSAN PÄÄKAUPUNKI –
- LECTURE 23 GENERAL CHARACTERISTICS OF THE DEPARTMENTS OF PTEROPSIDA
- IL COMUNE DI FERRARA CENTRO IDEA E SERVIZIO BIBLIOTECHE
- ARTISTES EN CORRESPONDANCE COLLOQUE INTERNATIONAL 14 ET 15 OCTOBRE
- KEEP BRITAIN TIDY INNOVATION IN PUBLIC SERVICES 210909 10
- PROVINCIA DI FERRARA COMUNE DI FERRARA LE CITTÀ DEGLI
- PREOPERATIVE STEROID USE AND RISK OF POSTOPERATIVE COMPLICATIONS IN
- RUBEN – MENTORSKAP I GRUPP 2014 BAKGRUND
- CONSUMER PROTECTION SLOVAK CUSTOMS ADMINISTRATION THE RIGHT AND DUTY
- SAFER EALING PARTNERSHIP TERMS OF REFERENCE INTRODUCTION THE
- TITULO (ESTILO TÍTULO – ARIAL NEGRITO14PT PARÁGRAFO 12PT DEPOIS
- LA POESÍA DEL SIGLO XX LA POESÍA DE POSGUERRA
- SPETTLE AZIENDA USL FERRARA DISTRETTO DI CENTO DIPARTIMENTO DI
- DETAILS ZUM FIAT PANDA 4X4 DER PANDA 4X4 WIRD
- NZQA EXPIRING UNIT STANDARD 11761 VERSION 5 PAGE 3
- CONTENIDO PAG I JUSTIFICACION 2 II OBJETIVOS GENERALES
- EDUCAÇÃO GRÁFICA BRASIL BAURU ISSN 21797374 V 25 NO
- SPORTOVNÍ KLUB STOLNÍHO TENISU BANÍK HAVÍŘOV POŘÁDÁ VELKOU CENU
 POWERPLUSWATERMARKOBJECT2169414 0 NOR310L0030SD OJ L 15310 P 112 DIRECTIVE
POWERPLUSWATERMARKOBJECT2169414 0 NOR310L0030SD OJ L 15310 P 112 DIRECTIVE WHAT IS IT? THE JUNIATA COLLEGE PUBLIC SAFETY DEPARTMENT
WHAT IS IT? THE JUNIATA COLLEGE PUBLIC SAFETY DEPARTMENTTemplate Letter ecc Claiming Costs of Double Cover
REGLAMENTO DE OFERTA PUBLICA DE ADQUISICION Y DE COMPRA
 THOMSON SCIENTIFIC AND INIST TO HONOR TOP FRENCH RESEARCHERS
THOMSON SCIENTIFIC AND INIST TO HONOR TOP FRENCH RESEARCHERS AJUNTAMENT DE PICASSENT CENTRE D’INFORMACIÓ JUVENIL REGIDORIA D’ESPORTS I
AJUNTAMENT DE PICASSENT CENTRE D’INFORMACIÓ JUVENIL REGIDORIA D’ESPORTS I CONTINGUT I ORGANITZACIÓ DE LA DOCUMENTACIÓ D’UN PROJECTE FINAL
CONTINGUT I ORGANITZACIÓ DE LA DOCUMENTACIÓ D’UN PROJECTE FINALIT IS UNDERSTOOD AND AGREED THAT OF THE ABOVE
ANNEX 2 FEATURES OF THE 3YEAR EXTENDABLE NOTES WHAT
 GRAFOLÓGIAI INTÉZET NÁLUNK A BETŰK MAGUKÉRT BESZÉLNEK! WWWGRAFINTHU ALAPÍTVA
GRAFOLÓGIAI INTÉZET NÁLUNK A BETŰK MAGUKÉRT BESZÉLNEK! WWWGRAFINTHU ALAPÍTVA RUSZA JUŻ SIÓDMA EDYCJA PROGRAMU! „NOWE TECHNOLOGIE DLA DZIEWCZYN”
RUSZA JUŻ SIÓDMA EDYCJA PROGRAMU! „NOWE TECHNOLOGIE DLA DZIEWCZYN”STANDART FORM 2 “TEBLİGAT İÇİN ADRES BEYANI” İTÜKKTC EĞİTİM
32 FRANK OTERHOLT PRESTHØGSKOLELEKTOR KIRKELIG PEDAGOGIKK I FORANDRING FRA
 EDUCV044 109E ZITTING 34 DECEMBER 2014 — BELLIARDSTRAAT 101
EDUCV044 109E ZITTING 34 DECEMBER 2014 — BELLIARDSTRAAT 101FORMULA COMPROBADA PARA OBTENER UN DIAMANTE LÍQUIDO 1 CULTIVO
 OBČANSKÉ SDRUŽENÍ EXULANT POŘÁDÁ K 590 VÝROČÍ UPÁLENÍ M
OBČANSKÉ SDRUŽENÍ EXULANT POŘÁDÁ K 590 VÝROČÍ UPÁLENÍ M TITLE MICHEL S ZYGMUNT1 BENOÎT DOUBLET2 AND AXEL CLOECKAERT3
TITLE MICHEL S ZYGMUNT1 BENOÎT DOUBLET2 AND AXEL CLOECKAERT3 ACADEMIA DE CIENCIAS DE CUBA EL PLENO DE LA
ACADEMIA DE CIENCIAS DE CUBA EL PLENO DE LA LEKCJA 4 OBSŁUGA SOW – MODUŁ REALIZATORA FILM 13
LEKCJA 4 OBSŁUGA SOW – MODUŁ REALIZATORA FILM 13 GLOBAL PHYSICAL ACTIVITY QUESTIONNAIRE (GPAQ) DER STEPWISE APPROACH ZUR
GLOBAL PHYSICAL ACTIVITY QUESTIONNAIRE (GPAQ) DER STEPWISE APPROACH ZUR