VERHÄLTNISFORMEL VON SALZEN STAND 01072018 JAHRGANGSSTUFEN 1112 FACHFÄCHER CHEMIE
Illustrierende Aufgaben zum LehrplanPLUS
Verhältnisformel von Salzen
Stand: 01.07.2018
|
Jahrgangsstufen |
11/12 |
|
Fach/Fächer |
Chemie |
|
Übergreifende Bildungs- und Erziehungsziele |
Alltagskompetenz und Lebensökonomie Technische Bildung |
|
Zeitrahmen |
45 Minuten |
|
Benötigtes Material |
Schüssler-Salze Nummer 1, 4, 7, 8, 12, 14, 18 |
Kompetenzerwartungen
Diese Aufgabe unterstützt den Erwerb folgender Kompetenzen:
Die Schülerinnen und Schüler …
bilden die Verhältnisformel von Salzen mithilfe der Ionenladung von Atom‑Ionen und vorgegebenen Molekül‑Ionen und leiten aus der Verhältnisformel die Mengenverhältnisse und Ladungszahlen der enthaltenen Ionen ab. (FOS C11 LB3 / BOS C12 LB3)
Aufgabe
Schüssler-Salze enthalten – wenn auch nur in sehr geringer Menge - lebenswichtige Mineralien. In der Homöopathie wird den Salzen durch Potenzierung gesundheitsfördernde Wirkung nachgesagt, die wissenschaftlich aber nie eindeutig bewiesen werden konnte. Hinter den Namen der Schüssler-Salze verbergen sich einfache chemische Substanzen.
-
Schüssler-Salz Nummer
Bezeichnung
Chemische Verbindung
1
Calcium Fluoratum
Calciumfluorid
4
Kalium Chloratum
Kaliumchlorid
7
Magnesium Phosphoricum
Magnesiumphosphat
8
Natrium Chloratum
Natriumchlorid
12
Calcium Sulfuricum
Calciumsulfat
14
Kalium Bromatum
Kaliumbromid
18
Calcium Sulfuratum
Calciumsulfid
Recherchieren Sie die Summenformeln für die Molekül-Anionen Phosphat und Sulfat.
Erstellen Sie eine Tabelle, in der Sie jedem Schüsslersalz die darin enthaltenen Ionen mit der jeweiligen Ladungszahl zuordnen. Verwenden Sie dabei das Periodensystem der Elemente, um die Ladungszahlen der Atomionen zu ermitteln. Vervollständigen Sie die Liste mit den Formeln der Phosphat- und Sulfat-Anionen.
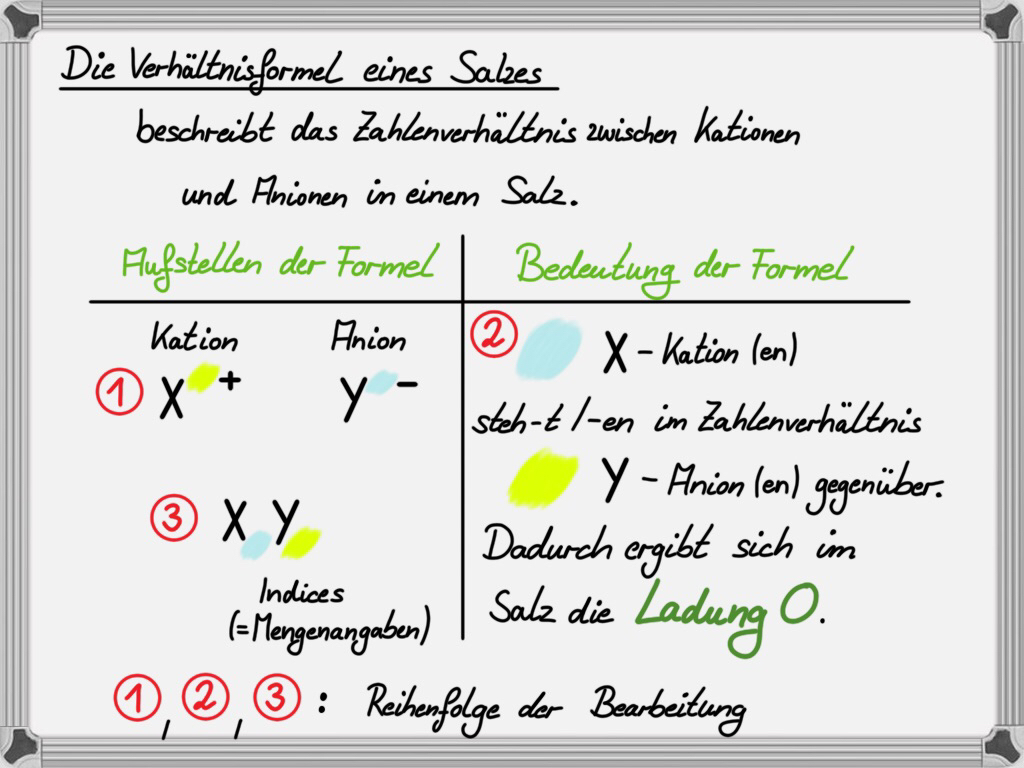
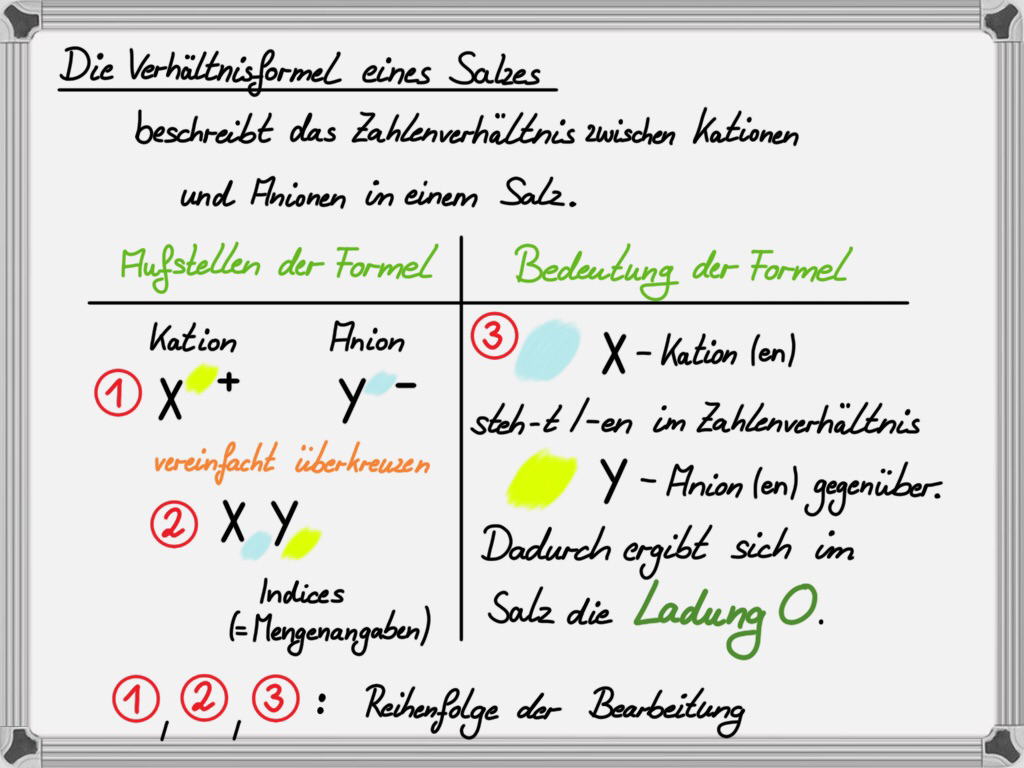
Leiten Sie das Zahlenverhältnis zwischen Kationen und Anionen im Ionengitter her (s. ggf. Hilfe 1 und 2).
Bilden Sie die Verhältnisformel der genannten Schüssler-Salze, indem Sie die Verhältniszahlen der Ionen kreuzen und als Indices angeben (s. ggf. Hilfe 1 und 2). Der Index „1“ muss nicht geschrieben werden.
Ergänzen Sie die Tabelle mit den Salzen Aluminiumoxid, Kaliumoxid, Lithiumnitrid und Magnesiumiumphosphid.
Hinweise zum Unterricht
Hilfe 1:
Hilfe 2:
Beispiele für Lösungen der Schülerinnen und Schüler
Chemische
Formel des Phosphat-Anions: PO43−
Chemische
Formel des Sulfat-Anions: SO42−
Ladung von Atom-Ionen:
-
Schüssler-Salz
Kation
Anion
Calciumfluorid
Ca2+
F−
Kaliumchlorid
K+
Cl−
Magnesiumphosphat
Mg2+
PO43−
Natriumchlorid
Na+
Cl−
Calciumsulfat
Ca2+
SO42−
Kaliumbromid
K+
Br−
Calciumsulfid
Ca2+
S2−
Zahlenverhältnis der Ionen im Ionengitter ermitteln (Ladungszahl „1“ muss nicht geschrieben werden):
-
Kation
Anion
Zahlenverhältnis
Kationen : AnionenCa2+
F(1)−
1 : 2
K(1)+
Cl(1)−
1 : 1
Mg2+
PO43−
3 : 2
Na(1)+
Cl(1)−
1 : 1
Ca2+
SO42−
1 : 1
K(1)+
Br(1)−
1 : 1
Ca2+
S2−
1 : 1
Bilden von Verhältnisformeln (Index „1“ muss nicht geschrieben werden):
|
Kation |
Anion |
Zahlenverhältnis |
Verhältnisformel |
|
Ca2+ |
F(1)− |
1 : 2 |
Ca1F2 |
|
K(1)+ |
Cl(1)− |
1 : 1 |
K(1)Cl(1) |
|
Mg2+ |
PO43− |
3 : 2 |
Mg3(PO4)2 |
|
Na(1)+ |
Cl(1)− |
1 : 1 |
Na(1)Cl(1) |
|
Ca2+ |
SO42− |
1 : 1 |
Ca(1)(SO4)(1) |
|
K(1)+ |
Br(1)− |
1 : 1 |
K(1)Br(1) |
|
Ca2+ |
S2− |
1 : 1 |
Ca(1)S(1) |
Ergänzen der Tabelle:
|
Kation |
Anion |
Zahlenverhältnis |
Verhältnisformel |
|
Al3+ |
O2− |
2 : 3 |
Al2O3 |
|
Li(1)+ |
O2− |
2 : 1 |
Li2O |
|
Li(1)+ |
N3− |
3 : 1 |
Li3N |
|
Mg2+ |
P3− |
3 : 2 |
Mg3P2 |
Seite
Tags: 01072018, verhältnisformel, jahrgangsstufen, fachfächer, chemie, salzen, stand
- 15 KETIDAKBERDOSAAN TUHAN YESUS MENURUT EDWAR IRVING SUATU DESKRIPSI
- Avery22825PrinttotheEdgeRoundLabels
- EJEMPLO DE CARTA PARA LOS PADRES ESTIMADOS PADRES O
- DARI TAHTA KEJAHATAN KEPADA KERAJAAN KRISTUS OLEH AUGUSTO QUIALA
- PRESENTING LIKE A PRO THE SUCCESS OF A
- 3GPP TSGRAN WG2 MEETING 110E R219XXXXX ELECTRONIC 1ST JUN
- RAZSTAVA PO NAROČILU KARLA KOFOL KUSTOSINJA TOLMINSKI MUZEJ TOLMINSKI
- BEZROBOCIE W WOJEWÓDZTWIE MAZOWIECKIM CZERWIEC 2010 NR 6 W
- V ÄSTERVIKS KOMMUN – SKOGSHAGASKOLAN BEDÖMNINGSMATRIS FÖR SO
- B IURO PROJEKTU MIEJSKO GMINNY OŚRODEK POMOCY SPOŁECZNEJ W
- MARY ROBINSON OPENING REMARKS LAUNCH OF THE REPORT
- MR2 PETŐFI RADIO A ROMANO DROM AZ 1998BAN HÁROM
- CORE COMPONENTS TEAM MAY 2001 CORE COMPONENTS STRUCTURE V104
- COPYRIGHT 2016 METAL ROOF INNOVATIONS LTD WWWS5COM SECTION 07
- NOTA DE PRENSA PRESS RELEASE UN PROYECTO DE A
- ZAGREB ILICA 242 TEL 01 49 23 796
- FUNDACIÓN ESCUELA POSGRADO PERSONERÍA JURÍDICA N° 147DECRETO N° 127301
- BROSZURA DLA RODZICÓW DZIECI Z NADPOBUDLIWOŚCIĄ PSYCHORUCHOWĄ NAJWAŻNIEJSZĄ SPRAWĄ
- 1158-CERTIFICATE-OF-INSURANCE-Closure-Postclosure
- EDUCATION POST‑DOCTORAL RESEARCH FELLOW STANFORD UNIVERSITY DEPARTMENT OF CHEMICAL
- ESTIMATION OF TARIFF ELASTICITY OF IMPORTS IN UKRAINE BY
- (VARDAS PAVARDĖ) (NAMŲ ADRESAS) (KONTAKTINIS TELEFONAS
- FY 2007 MMI FUND ANALYSIS ACTUARIAL REVIEW SECTION V
- 20142015 ÖĞRETİM YILI YAZ OKULU KAYIT ESASLARI YAZ OKULU
- PREDLAGATELJ ŽUPAN OBČINE ŽIROVNICA PRISTOJNOST OBČINSKI SVET OBČINE
- GRIPE PORCINA PROTÉJASE Y PROTEJA SU FAMILIA SEGURAMENTE HA
- UNIVERSIDAD DE ALCALÁ AREA DE CONOCIMIENTO CATEGORÍA DEDICACIÓN
- IZPOLNI ZPM DATUM PREJEMA ZAPISNA ŠT
- LIKOVIVODITELJ LEDENKO ZIMIĆSTARA GODINA NOVA GODINA DJED BOŽIĆNJAK PAHULJICE
- G ENERALITAT DE CATALUNYA DEPARTAMENT D’EDUCACIÓ INSTITUT CARLES VALLBONA
STANDARDS – BASED INSTRUCTIONAL UNIT SUBJECT MUSIC GRADELEVEL 912
 TC MARDİN ARTUKLU ÜNİVERSİTESİ SAĞLIK BILIMLERI FAKÜLTESI DEKANLIĞI GÖREV
TC MARDİN ARTUKLU ÜNİVERSİTESİ SAĞLIK BILIMLERI FAKÜLTESI DEKANLIĞI GÖREV NAVODILA ZA IZDELAVO POSLOVNEGA NAČRTA ZA IZVEDBO NALOŽB GOSPODARSKIH
NAVODILA ZA IZDELAVO POSLOVNEGA NAČRTA ZA IZVEDBO NALOŽB GOSPODARSKIH LOS NIÑOS Y EL DIVORCIO UNA MANERA POSITIVA DE
LOS NIÑOS Y EL DIVORCIO UNA MANERA POSITIVA DEKOMÁROMI NAPOK 2008 (FÉLKÖVÉRREL A DÉLKOMÁROMI DŐLT BETŰVEL AZ
ROUTING FEATURES SELECTIVE ROUTING DEFAULT ROUTING
MINISTERSTVO ZEMĚDĚLSTVÍ TĚŠNOV 17 117 05 PRAHA 1 V
SELMA CHICCO HAJDIN ROJENA V KOPRU JE ZAČELA GLASBENO
SCOPE AND SEQUENCE MATH – 4TH GRADE 2013
OZNACZENIE SPRAWY PN – 42014 INFORMACJA Z OTWARCIA OFERT
CASACIÓN 40629 ANDRÉS FELIPE GUIRAL MARTÍNEZ ANDRÉS FELIPE OSORIO
LIST OF FOREIGN CORRESPONDENTS СПИСОК БАНКОВ КОРРЕСПОНДЕНТОВ ОАО «РСК
LISTA DE MARCAS DE ACEITE CERTIFICADAS EXENTAS DE HIDROCARBUROS
 FACULTAT DE MATEMÀTIQUES I INFORMÀTICA GRAN VIA DE LES
FACULTAT DE MATEMÀTIQUES I INFORMÀTICA GRAN VIA DE LES 1 TEDEN DOPOLDANSKA MALICA KOSILO PONEDELJEK 3012017 KORUZNI KRUH
1 TEDEN DOPOLDANSKA MALICA KOSILO PONEDELJEK 3012017 KORUZNI KRUHEXPLORATORY QUESTIONS FOR FIGHT CLUB SUPPORT YOUR RESPONSES WITH
HUBERTO JUÁREZ NÚÑEZ NUEVOS SISTEMAS DE INTEGRACIÓN INDUSTRIAL Y
CSU CHICO EMERGENCY PROCEDURES FOR FACULTYLED INTERNATIONAL PROGRAMS OVERVIEW
 24 CLASSROOM ACTION RESEARCH IN LANGUAGE LEARNING BY
24 CLASSROOM ACTION RESEARCH IN LANGUAGE LEARNING BYEL MAESTRO Y LA MAESTRA COMO EDUCADORES UNA IRRENUNCIABLE