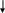COLEGIO SIGLO XXI LAMPA ASIGNATURA CIENCIAS NATURALES CURSO
PAUTAS DE ORGANIZACIÓN NIVEL INICIAL EL COLEGIOCOLEGIO OFICIAL DE ARQUITECTOS DE GRANADA PLAZA
COLEGIO OFICIAL DE INGENIEROS TÉCNICOS INDUSTRIALES DE CÓRDOBA
COLEGIO SAN AGUSTÍN FÍSICA Y QUÍMICA 4º
COLEGIO SANTÍSIMA TRINIDAD SEVILLA DPTO DE MATEMÁTICAS CURSO
SOLICITUD DE ADHESIÓN DE CLIENTES EN COLEGIO DE
MATERIAL TÉCNICOPARA EL DOCENTE
 COLEGIO
SIGLO XXI - LAMPA
COLEGIO
SIGLO XXI - LAMPA
Asignatura: Ciencias Naturales
Curso: 2°ciclo
Docente:
J
GUÌA CLASE 6 (configuración electronica)
Día 09 de abril
Objetivos de Aprendizaje: Comprender el comportamiento de los electrones en el átomo en base a nociones del modelo mecano-cuántico.

|
Indicaciones para trabajar tus guías desde la distancia
- +No olvides visita los links insertos en las guías (solo si los hubiera por actividad). - Debes responder las actividades directamente en el archivo Word si dispones de computadora o una hoja cuadriculada que puedas archivar en una carpeta o en tu texto de estudio. Sigue las indicaciones de tu profesor. - Si respondes de forma escrita manual, archiva tu guía en una carpeta, que deberá ser “por asignatura”. Estas se revisarán y evaluarán al regreso a clases. - Si respondes en el archivo Word y hay alguna actividad de producción o de dibujo, debes tomarle una foto (o escanearla) y adjuntarla al archivo para que los envíes por correo. Siempre que puedas, de lo contrario la imprimes y archivas en tu carpeta, según la asignatura. - Siempre pide ayuda a tu familia para enviar tus tareas por correo, donde indique en el “asunto” tu nombre y la asignatura que estás evidenciando. - Puedes enviar tus respuestas al correo del curso, si deseas que tu profesor evalúe y retroalimente tu creación antes del regreso a la escuela, de lo contrario, guarda los documentos según lo ya explicado. -Si subes imágenes de tu trabajo, saca la mejor foto (o escanéalo) y envíalo vía correo, asegúrate de que se note bien tu trabajo para evaluar lo realizado. Guarda siempre tu guía en la carpeta para ver el documento a nuestro regreso. Recuerda que no es exigencia enviar por correo el desarrollo de tu trabajo, pero SÍ, debes guardarlo en carpetas separadas para su revisión y evaluación a nuestro regreso al colegio. |
Actividades: En la guía.
Objetivo de la clase: • realizar configuraciones elctrónicas de distintos atomos
1. Lee la siguiente información sobre configuración electrónica y desarrolla las actividades que vienen a continuación:
|
Configuración Electrónica
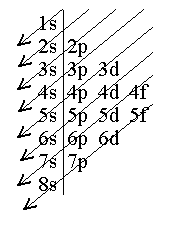
L La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal o diagrama de Moeller, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
Aplicando
el mencionado cuadro de las diagonales la configuración
electrónica estándar para cualquier átomo es
la siguiente:
1s2
2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
4d10 5 p6 6s2 4f14 5d10 6p6 7s2 5f14
6d10 7p6 Más
adelante explicaremos como se llega a este enjambre de número
y letras que perturba inicialmente, pero que es de una simpleza
sorprendente.
Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+). Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1). Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Además se debe respetar los siguientes postulados:
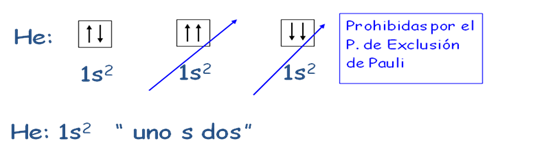
Mínima energía de Aufbau: Los electrones se ubican primero en los orbitales de menor energía. Exclusión de Pauli: Los orbitales son ocupados por un máximo de 2 electrones siempre con spin diferente.
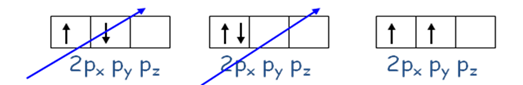
Máxima multiplicidad de Hund: En orbitales de la misma energía los electrones entran de a uno. Ocupando cada orbita con el mismo spín. Cuando se alcanza el semillenado comienza el apareamiento con los spín opuestos.
Ejemplo: la configuración electrónica del carbono (C) es: 1s2 2s2 2p2 hay tres maneras de colocar los electrones del subnivel 2p que son:
Sin embargo, solo uno sigue la regla de Hund.
Antes de comenzar a escribir configuraciones electrónicas recordemos algunos conceptos que debes manejar:
Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno o cercano al núcleo, al 7, el más externo o lejano del núcleo. Cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. De esta manera tenemos: 1 orbital tipo s 3 orbitales p 5 orbitales d 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s 6 en el p (2 electrones x 3 orbitales) 10 en el d (2 electrones x 5 orbitales) 14 en el f (2 electrones x 7 orbitales)
La configuración electrónica en la corteza de un átomo es la distribución de sus electrones en los distintos niveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energía creciente hasta completarlos.
“Es importante saber cuántos electrones existen en el nivel más externo de un átomo pues son los que intervienen en los enlaces con otros átomos para formar compuestos, estos últimos electrones se denominan ELECTRONES DE VALENCIA”. Formas de escribir la configuración electrónica
Utilizaremos 3 formas de escribir la configuración electrónica de los elementos, estas son:
Global: se ubican los electrones según la capacidad de nivel y subnivel. Global externa: se indica entre corchetes el gas noble anterior al elemento configurado y posteriormente los niveles y subniveles no incluidos en ese gas noble. Esta configuración es muy útil para visualizar los electrones de Valencia. Diagrama de orbitales: se simboliza cada orbital por un recuadro o casillero dentro del cual los electrones se representan con flechas hacia arriba o hacia abajo (spín + o -).
Ejemplo: Configuremos el sodio (Na)
Los átomos neutros de este elemento tienen un número atómico igual a 11, por lo tanto tienen 11 electrones.
Configuración global: 1s2 2s2 2p6 3s1
Configuración global externa: [Ne] 3s1
1s2 2s2 2p6 3s1
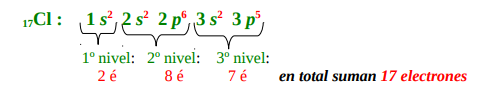
EJEMPLO Configuración electrónica del CLORO ( 17 Cl ): Debemos dar la distribución electrónica para el elemento CLORO, que como su numero atómico indica tiene 17 electrones . Para ello seguimos la regla de las diagonales, como se representa más arriba. En el ejemplo del CLORO sería: 1 s2 , continuando con la siguiente diagonal tengo 2s2 , como siguiendo la diagonal no tengo otro dato busco la siguiente diagonal y tengo 2 p6 , siguiendo la diagonal tengo 3 s2 y finalmente 3p6 Siempre se deben ir sumando los superíndices, que indican la cantidad de electrones. Si sumo los superíndices del ejemplo, obtengo 18, quiere decir que tengo un electrón de más, ya que mi suma correcta debe dar 17, por lo que al final debo corregir para que quede 3 p5 .
Ahora, si analizamos detenidamente lo que pasa en cada orbital, podemos ver que: ✔ En el subnivel s del 1º nivel los dos electrones se encuentran en el orbital tipo s ✔ En el subnivel s del 2º nivel los dos electrones se encuentran en el orbital tipo s. ✔ En el subnivel p del 2º nivel los seis electrones se encuentran de dos en dos en cada orbital tipo p ✔ En el subnivel s del 3º nivel los dos electrones en el orbital s. ✔ En el orbital tipo p del 3º nivel los cinco electrones se encuentran de dos en dos en los orbitales px y py, pero en el orbital pz solo existe un electrón, o sea:
|
ACTIVIDADES:
1.- Escribe la configuración electrónica global, global externa y diagrama de orbitales de los elementos 1 al 36.
|
Elemento |
Conf. global |
Conf. global externa |
Diagrama de orbitales |
|
1 H |
|
|
|
|
2 He |
|
|
|
|
3 Li |
|
|
|
|
4 Be |
|
|
|
|
5 B |
|
|
|
|
6 C |
|
|
|
|
7 N |
|
|
|
|
8 O |
|
|
|
|
9 F |
|
|
|
|
10 Ne |
|
|
|
|
11 Na |
|
|
|
|
12 Mg |
|
|
|
|
13 Al |
|
|
|
|
14 Si |
|
|
|
|
15 P |
|
|
|
|
16 S |
|
|
|
|
17 Cl |
|
|
|
|
18 Ar |
|
|
|
|
19 K |
|
|
|
|
20 Ca |
|
|
|
|
21 Sc |
|
|
|
|
22 Ti |
|
|
|
|
23 V |
|
|
|
|
24 Cr |
|
|
|
|
25 Mn |
|
|
|
|
26 Fe |
|
|
|
|
27 Co |
|
|
|
|
28 Ni |
|
|
|
|
29 Cu |
|
|
|
|
30 Zn |
|
|
|
|
31 Ga |
|
|
|
|
32 Ge |
|
|
|
|
33 As |
|
|
|
|
34 Se |
|
|
|
|
35 Br |
|
|
|
|
36 Kr |
|
|
|
SOLICITUD DE ALTA BOLSA DE EMPLEO COLEGIO
(MODELO DE QUEJA DEONTOLÓGICA) AL ILUSTRE COLEGIO DE ABOGADOS
1 SOCIEDADES E INSTITUCIONES COLEGIO OFICIAL DE FÍSICOS
Tags: asignatura para, la asignatura, asignatura, ciencias, naturales, siglo, colegio, lampa, curso
- PRESENTACIÓN DEL PROYECTO EUROPEO HERA SOBRE GESTIÓN POLICIAL EN
- GMC SALES HEAT UP IN JULY TERRAIN ACADIA SIERRA
- UPDATE NOVEMBER 2019 D EAR VOLUNTEER I WISH TO
- FIREFLEX N2BLAST® INTEGRATED FIRE PROTECTION SYSTEMS BY FIREFLEX
- SCORING RUBRIC FOR SUITCASE NAME WRITING (20 POINTS EACH)
- X VI AQUA VIVAE SPORTSKIH IGARA UČENIKA ZA 2017
- DISEÑO DE UN SOCKET AJUSTABLE PARA PRÓTESIS DE MIEMBRO
- A LA SUBDIRECCIÓN GENERAL DE MEDIOS PERSONALES AL SERVICIO
- WOJCIECH BĄKOWSKI „ODNALEZIENIE SIEBIE” 2013 DZIĘKI UPRZEJMOŚCI ARTYSTY I
- PRESSMEDDELANDE 20181024 NY UPPTÄCKT AV HUR ELEKTRONER FÅR
- 2 ALMU’RAB WA ALMABNI A CONTOH KALIMAT 1 الكتابُ
- LA DOCTRINA ISLÁMICA QUÉ LA CONTRADICE Y QUÉ
- CATEGORIA ALEVIN CLARA SANCHEZ ASENSIO ALEVIN ARO CDR VALLISOLETANA
- FLOODPLAIN DEVELOPMENT PERMIT APPLICATION NONBUILDING SITUATION GENERAL INFORMATION PERMIT
- HOMEOWNER REPORT—TECHNICAL NOTE THE DATA RELEASED BY THE CENSUS
- ARTICLE CODE………… ARTICLE REVIEW IN GENERAL AND PROFESSIONAL EDUCATION
- 54 Vegetacijski pas na Predlaganem ali Nekem Podobnem Mestu
- LINE 1 LINE 2 LINE 3 5 H 91
- 6 1 ZAŁĄCZNIK NR 2 FORMULARZ CENOWY – 2
- CONSULTATION NATIONALE BAC STI 2007 SPÉCIALITÉ INGÉNIERIE DES
- ROADSHOW MEXICAN RESEARCH INSTITUTES AND UNIVERSITIES GERMANY JUNE 2008
- RIWAYAT DARI NABI MUHAMMAD SAW & DUA BELAS IMAM
- CHECK IN TEST OBJECTIVES AND STRATEGY QUESTIONS
- SEMINARIO ELABORACIÓN Y REDACCIÓN DE INFORMES DICTÁMENES Y RECOMENDACIONES
- 10 KONCEPCJA PRACY ZESPOŁU SZKÓŁ W KOWALOWIE NA ROK
- KRAKÓW DNIA (IMIĘ I NAZWISKO)
- GR2 FORM GRADING REVIEW REQUEST FORM EXISTING POSTS WITH
- ZÁPIS Z PLÉNA ČLENŮ (ČLENSKÉ SCHŮZE) KLUB PŘÁTEL ŠKOLY
- VUELO CANCELADO LOS PIES LE COLGABAN AL OTRO LADO
- NOWEMIASTO NP DN15032010R ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY 1NA
CENTAR ZA SOCIJALNU SKRB ZAGREB 10000 ZAGREB EUGENA KUMIČIĆEVA
 MEMORANDUM OF UNDERSTANDING BETWEEN DIRECTOR TRANSPORT SAFETY AND VICTORIA
MEMORANDUM OF UNDERSTANDING BETWEEN DIRECTOR TRANSPORT SAFETY AND VICTORIA UNIDAD 9 QUÍMICA ORGÁNICA IES CLARA CAMPOAMOR (GETAFE) QUÍMICA
UNIDAD 9 QUÍMICA ORGÁNICA IES CLARA CAMPOAMOR (GETAFE) QUÍMICA 3 GRUPO FORMATO TABLAS DE RETENCIÓN DOCUMENTAL – TRD
3 GRUPO FORMATO TABLAS DE RETENCIÓN DOCUMENTAL – TRDPRILAGODBA NA JASLICEVRTIĆ KADA VAŠE DIJETE KRENE U JASLICE
 TABANIDPROOF ZEBRAS SUPPLEMENTARY MATERIAL ÁDÁM EGRI ET AL ELECTRONIC
TABANIDPROOF ZEBRAS SUPPLEMENTARY MATERIAL ÁDÁM EGRI ET AL ELECTRONIC JORNADAS CONGRESOS Y SIMILARES RECAUDACIÓN DE INSCRIPCIONESCUOTAS UNIDAD OTROS
JORNADAS CONGRESOS Y SIMILARES RECAUDACIÓN DE INSCRIPCIONESCUOTAS UNIDAD OTROS 1 JAKI JEST PODZIAŁ SPEKTROSKOPII WG A ZAKRESU DŁUGOŚCI
1 JAKI JEST PODZIAŁ SPEKTROSKOPII WG A ZAKRESU DŁUGOŚCIACCORDO DI INTERPRETAZIONE AUTENTICA DELL’ ART 1 COMMA 3
 KYSELINY A ZÁSADY ARRHENIOVA TEORIE – S ARRHENIUS
KYSELINY A ZÁSADY ARRHENIOVA TEORIE – S ARRHENIUS  UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE ODONTOLOGIA PROGRAMA DE
UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE ODONTOLOGIA PROGRAMA DEMONIKA CAŁKIEWICZ MODUS OPERANDI SPRAWCÓW ZABÓJSTW MONIKA CAŁKIEWICZ
SZCZEGÓŁOWE WYMAGANIA NA POSZCZEGÓLNE OCENY W KLASIE SZÓSTEJ OCENĘ
PREDSJEDNIK GRADSKOG VIJEĆA GRADA SAMOBORA OTVARA AKTUALNI SAT JOSIP
WTREGM52 PAGE 5 WORLD TRADE ORGANIZATION RESTRICTED WTREGM52 10
 REPUBLIKA HRVATSKA SISAČKOMOSLAVAČKA ŽUPANIJA GRAD GLINA JEDINSTVENI UPRAVNI ODJEL
REPUBLIKA HRVATSKA SISAČKOMOSLAVAČKA ŽUPANIJA GRAD GLINA JEDINSTVENI UPRAVNI ODJELANNEX II ANEXO II MODEL DE CURRÍCULUM
ROLA RODZICÓW W KSZTAŁTOWANIU ROZWOJU EMOCJONALNEGO DZIECI I JEGO
ANY RESEARCH USING THE CLINICAL RESEARCH CENTER FACILITIES REQUIRES
 LA BIODIVERSIDAD WEBQUEST WEBQUEST BIODIVERSIDAD DIVERSIDAD ES CALIDAD INTRODUCCIÓN
LA BIODIVERSIDAD WEBQUEST WEBQUEST BIODIVERSIDAD DIVERSIDAD ES CALIDAD INTRODUCCIÓN
 Responde las guías en las fechas que se te indican
(pudiendo adelantar si quieres). El ideal es que utilices
la
hora de la asignatura
para ejecutar tus actividades y no te atrases en tus evaluaciones
semanales.
Responde las guías en las fechas que se te indican
(pudiendo adelantar si quieres). El ideal es que utilices
la
hora de la asignatura
para ejecutar tus actividades y no te atrases en tus evaluaciones
semanales.
 a
configuración electrónica del átomo de un
elemento corresponde a la
a
configuración electrónica del átomo de un
elemento corresponde a la