様式第十六(二)(第三十三条、第百三十七条の十六関係) FORM NO 16 (2) (RELATED TO ARTICLE 33
様式第十六(二)(第三十三条、第百三十七条の十六関係) FORM NO 16 (2) (RELATED TO ARTICLE 33
様式第十六(一)(第三十三条関係)
様式第十六(二)(第三十三条、第百三十七条の十六関係)
Form No. 16 (2) (related to Article 33 and Article 137-16)
医薬品
医薬部外品
再生医療等製品
認定
認定の更新
外国製造業者 調査申請書
accreditation
accreditation renewal
Application for examination for of foreign
drug quasi-drug regenerative,
cellular therapy and gene therapy products
manufacturer
|
|
製造所の名称 Name of the manufacturing establishment |
|
|
|
|
製造所の所在地 Location of the manufacturing establishment |
|
|
|
|
認定の区分 Accreditation categories |
|
|
|
|
認定番号及び年月日 (更新の場合) Number and date of the accreditation (In the case of renewal) |
|
|
|
|
手数料区分 Fee categories |
|
|
|
|
調査手数料金額 Amount of examination fee |
|
|
|
|
備考 Remarks |
|
|
認定 認定の更新
医薬品
医薬部外品
再生医療等製品
上記により、 の外国製造業者の に係る調査を申請します。
accreditation
accreditation renewal
I hereby apply for the examination for of the foreign
drug quasi-drug regenerative,
cellular therapy and gene therapy products
manufacturer indicated above.
年 月 日
Year Month Day 邦文
Japanese
 住 所
住 所
Address 外国文
法人にあつては、主たる事務所の所在地 Location
of the head office in case of a corporation
邦文 又は署名
Japanese Signature
 氏 名
氏 名
Name 外国文
(
)
法人にあつては、名称及び代表者の氏名 Name
and name of its representative in case of a corporation
独立行政法人医薬品医療機器総合機構理事長 殿
To Chief Executive of the Pharmaceuticals and Medical Devices Agency
(注意)
(Notes)
1 用紙の大きさは、日本工業規格A4とすること。
Use paper of Japanese Industrial Standards Size A4.
2 字は、墨、インク等を用い、邦文にあつては、楷書ではつきりと書くこと。
Fill in the form with clear writing with inks, etc.,.
3 認定の区分欄には、第36条第1項及び第2項各号又は第137条の19各号のいずれに該当するかを記載すること。
Identify in the column of “Accreditation categories” which category specified under Article 36, Paragraph 1 and 2 or Article 137-19 is applied.
4 手数料区分欄には、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係手数料令において定める区分を記載すること。
Identify in the column of “Fee categories” which category specified under the Cabinet Order for Fees related to the Act on Securing Quality, Efficacy and Safety of Pharmaceuticals, Medical Devices, Regenerative and Cellular Therapy Products, Gene Therapy Products, and Cosmetics is applied.
5 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係手数料令において定める手数料を機構の口座に払い込んだことを証する書類の写しを裏面に貼付すること。
Attach to the reverse of this form a copy of the document proving payment of the fee specified under the Cabinet Order for Fees related to the Act on Securing Quality, Efficacy and Safety of Pharmaceuticals, Medical Devices, Regenerative and Cellular Therapy Products, Gene Therapy Products, and Cosmetics through a bank transfer to the account of the Pharmaceuticals and Medical Devices Agency.
6 これまでに機構による外国製造業の認定に係る調査を受けたことがある場合には、備考欄に前回調査申請日及び結果通知日について記載すること。
If the applicant has previously been the subject of the examination for accreditation of foreign manufacturer by the Pharmaceuticals and Medical Devices Agency, specify in the column of “Remarks” the date of the previous application and the notification date of the result.
Tags: (related to, (related, article, 様式第十六(二)(第三十三条、第百三十七条の十六関係)
- ÚTMUTATÓ A TUDOMÁNYOSOKTATÁSI TEVÉKENYSÉGET ISMERTETŐ ÉVES BESZÁMOLÓ ELKÉSZÍTÉSÉHEZ I
- SOLICITUD DE MODIFICACIÓN COMO CONSECUENCIA DEL COVID19 DE INTERVENCIONES
- BESZÁMOLÓ A SZÉKESFEHÉRVÁR VÁROSI TERMÉSZETBARÁT SZÖVETSÉG 2018 ÉVI TEVÉKENYSÉGÉRŐL
- VŠEOBECNÉ PODMÍNKY SOUTĚŽE SPOLEČNOSTI NEJ TV AS MAJITELE A
- MINUTES 2008 BUSINESS MEETING MRCSOT THE MIDWEST REGIONAL CHAPTER
- CURRICULUM VITAE DR IR ROELAND CE KINDT 2003 –
- PAPEL TIMBRADO DA EMPRESA COM RESPECTIVO CNPJ DECLARAÇÃO DE
- EVALUATION AND STRUCTURE OF COMMERCIAL BANKS IN INDIA VINOD
- ARCHDIOCESE OF INDIANAPOLIS WEDDING POLICIES A THE ARCHDIOCESE OF
- THE GETTY ADVANCED SEARCH HOME VISIT THE GETTY THE
- 6 A NECESIDADE DA PARTICIPACIÓN PLENA DOS MAIORES NA
- MEDIJSKA KULTURA – KAZALIŠTE KAZALIŠTE – KUĆA U
- B OLETO DE COMPRAVENTA DE CEREALES OLEAGINOSOS Y DEMAS
- COMMUNITY SCHOOL DEED OF TRUST AMALGAMATED SCHOOL MODEL LEASE
- SUPPORTING DOCUMENT 1 COMPARATIVE NUTRITIONAL SAFETY ASSESSMENT – APPLICATION
- LOS SEGUROS MÁS BARATOS CON UN TRATO PERSONALIZADO CEA
- OBAVIJEST O UPISU KANDIDATA U VATROGASNU ŠKOLU ZA ŠKOLSKU
- SPORTSCHÜTZENVERBAND ALFELD FEIERT SEINE MAJESTÄTEN ZUM KÖNIGSBALL DES SPORTSSCHÜTZENVERBANDES
- TO TMT OBSERVATORY PROJECT OFFICE OF THE CHANCELLOR UNIVERSITY
- THEME UNDERSTANDING COMMUNICATION ACTIVITY THE BRIALLE ALPHABET
- UPDATE 08052001 1030 AM SECURITY CONTROLS ORIGINALLY PUT IN
- REPUBLIKA HRVATSKA DJEČJI VRTIĆ ZVIREK STUBIČKE TOPLICE KLASA40002200101 URBROJ211327042011
- BUENOS AIRES…… SR RECTOR UNIVERSIDAD DE BUENOS AIRES PROF
- STATE LAW LIBRARY OF MONTANA JUSTICE BUILDING
- OTL AICHER EL MUNDO COMO PROYECTO (1991) …LOS
- SOLUCIONARIO GUÍA N°19 LENGUAJE Y COMUNICACIÓN QUINTO BÁSICO NOMBRE
- NA TEMELJU ČLANKA 40 STATUTA GRADSKOG SATIRIČKOG KAZALIŠTA ¨KEREMPUH¨
- INSTRUCTIVO CAMBIO DE DOMICILIO (CASA MATRIZ O SUCURSAL) CAMBIO
- GABRIEL KELEMEN – CYMATICS CÂND SUNETUL ÎNTÂLNEȘTE MATERIA 28
- ZAŁĄCZNIK NR 9 DO SWZ PN – 8921KK DOTYCZY
JAZZ–IRODALOM A TANTÁRGY ÁLTALÁNOS CÉLJAI FELADATAI ISMERTESSE MEG A
 FAMILY LEAVE – CARER POLICY ISSUED BY THE HUMAN
FAMILY LEAVE – CARER POLICY ISSUED BY THE HUMAN ENFERMEDAD DE CREUTZFELDT – JAKOB EN CHILE 19851998
ENFERMEDAD DE CREUTZFELDT – JAKOB EN CHILE 19851998  17 ZAŁĄCZNIKI ZAŁĄCZNIK A MIĘŚNIE PREDYLEKCYJNE ABY
17 ZAŁĄCZNIKI ZAŁĄCZNIK A MIĘŚNIE PREDYLEKCYJNE ABYSLUTPLÄDERING MIAHABO LYCKSELELULETINGSRÄTT 15 FEBRUARI 2012 DET ÄR INTE
 REGULAMIN IV RAJD ROWEROWY Z LOKALNĄ GRUPĄ DZIAŁANIA DORZECZA
REGULAMIN IV RAJD ROWEROWY Z LOKALNĄ GRUPĄ DZIAŁANIA DORZECZANASKAH MONOLOG MONOLOG PEPERANGAN OLEH R GIRYADI SEBELUM
 PHOTOGRAPHY CONSENTMODEL RELEASE FORM FOR MINOR CHILDREN (UNDER 18)
PHOTOGRAPHY CONSENTMODEL RELEASE FORM FOR MINOR CHILDREN (UNDER 18) 4 HELSINGØR KOMMUNE 28022011 BØRNE OG UNGEUDVALGET 113916 VEDR
4 HELSINGØR KOMMUNE 28022011 BØRNE OG UNGEUDVALGET 113916 VEDRPIELIKUMS NR6 PĒTĪJUMĀ IZMANTOTO MATERIĀLU UN AVOTU SARAKSTS
 VACCINAZIONE CONTRO IL PAPILLOMA VIRUS L’ITALIA È IL
VACCINAZIONE CONTRO IL PAPILLOMA VIRUS L’ITALIA È IL JABATAN PERTANIAN ( DEPARTMENT OF AGRICULTURE ) BAHAGIAN
JABATAN PERTANIAN ( DEPARTMENT OF AGRICULTURE ) BAHAGIAN TITLE OF THE COURSE COMPUTER GRAPHICS COURSE CODE NMM
TITLE OF THE COURSE COMPUTER GRAPHICS COURSE CODE NMM HOJA Nº 857 LEY Nº 1680 PODER LEGISLATIVO LEY
HOJA Nº 857 LEY Nº 1680 PODER LEGISLATIVO LEY WIPOACE66 PAGE 10 E WIPOACE66 ORIGINAL ENGLISH DATE SEPTEMBER
WIPOACE66 PAGE 10 E WIPOACE66 ORIGINAL ENGLISH DATE SEPTEMBERTRAFFIC MANAGEMENT PLAN FOR WORK AND SERVICES FOR THE
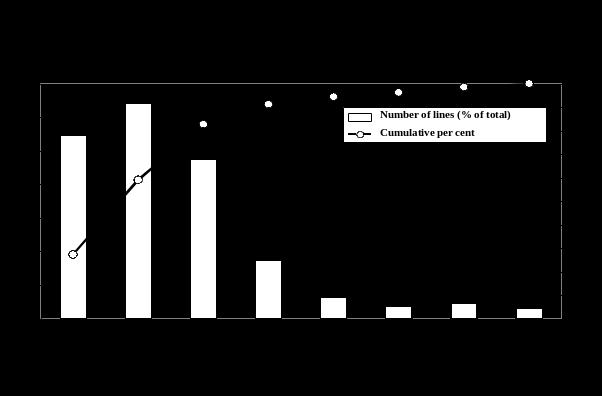 EUROPEAN COMMUNITIES WTTPRS136 PAGE 82 IIITRADE POLICIES AND PRACTICES
EUROPEAN COMMUNITIES WTTPRS136 PAGE 82 IIITRADE POLICIES AND PRACTICES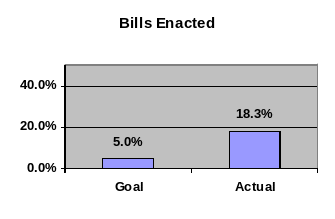 Iowa Commission on the Status of Women aga Performance
Iowa Commission on the Status of Women aga Performancenot Protectively Marked Essex County Neighbourhood Watch Association County
 UTFYLT DATO DRIFTSLEDERS SIGN HÅNDBOK FOR INTERNKONTROLL
UTFYLT DATO DRIFTSLEDERS SIGN HÅNDBOK FOR INTERNKONTROLL