CHAPITRE 1 CHAPITRE 2 CHAPITRE 3 CHAPITRE 4 EXERCICE
1IÈRE S THEME OBSERVER TP CHAPITRE 53 ENGLISH CHAPITRE 3 LOI MODIFIANT LA LOI DE
3 ENGLISH CHAPITRE 36 LOI MODIFIANT LA LOI SUR
39 ENGLISH CHAPITRE 12 LOI ÉDICTANT LA LOI DE
4 CHAPITRE 2 ENTREPRISES ET PRODUCTION I LA
41 ENGLISH CHAPITRE 6 LOI MODIFIANT LA LOI SUR
Chapitre
1 Chapitre
2 Chapitre
3 Chapitre
4 Exercice Questions
Nom :
Unité
1 :
Étude
des propriétés de la matière
10-4


Nom :
Chapitre 1 : Comprendre la matière
1.1 : Des produits chimiques autour de nous pp. 6-9
Les produits chimiques sont prévalent dans la vie quotidienne.
Exemples des produits chimiques que tu utilises à la maison :
1.
2.
3.
Plusieurs produits chimiques que l’on utilise à la maison pourraient devenir dangereux.
Exemples des produits chimiques dangereux dans ta maison :
1.
2.
3.
Certains produits chimiques présentent un danger s’ils ne sont pas entreposés et éliminés de façon appropriée.
Ex. L’eau de Javel et de l’ammoniac ensemble peuvent provoquer de fortes réactions – il faudrait les entreposer dans des endroits distincts.
Il ne faut pas entreposer les produits chimiques dans les égouts ou de les jeter dans les sites d’enfouissement des déchets – ça peut nuire à l’environnement.
D’habitude, les produits chimiques dangereux portent une étiquette donnant des renseignements sur leur élimination.
SIMDUT : .
Les symboles SIMDUT nous donnent des renseignements sur la façon d’entreposer, de manipuler et d’éliminer tout produit chimique trouvé sur un lieu de travail.
Symboles de SIMDUT :
|
Matières dangereusement réactives
|
Matières comburantes |
Matières corrosives |
Matières infectieuses |
|
|
|
|
|
|
Matières inflammables/ combustibles |
Matières toxiques ayant des effets immédiats et graves |
Gaz comprimés |
Matières toxiques ayant d'autres effets |
3 approches permettant de faire circuler l’information :
1.
2.
3.
Les symboles qui apparaissent sur les produits que tu utilises à la maison sont appelés symboles des produits ménagers dangereux

: Décrire la matière (p. 10-12)
Matière :
Théorie :
La théorie particulière de la matière permet d’expliquer ce que les scientifiques ont appris sur la nature de la matière.
La
théorie
particulière de la matière
Les états de la matière
SOLIDE :
L es
particules sont très
unes des autres
es
particules sont très
unes des autres
Les particules se déplacent .
Dessin :
LIQUIDE :
Les particules sont plus celles d’un solide
Les particules se .

Dessin :
GAZEUX
Les particules sont assez entassées les unes sur les autres
L es
particules se déplacent .
es
particules se déplacent .
Dessin :
LES PROPRIÉTÉS DE LA MATIÈRE
Propriété physique :
Exemples des propriétés physiques :
-
-
-
Propriété chimique :
Exemples des propriétés chimiques :
-
-
-
-
-
1.3 : Une classification de la matière (p. 15 – 17)
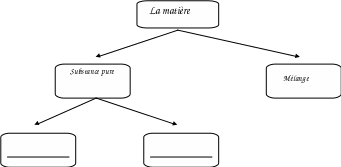
Substance pure :
Exemples des substances pures :
-
-
Mélange :
Exemples des mélanges :
-
-
Comment est-ce que on peut distinguer une substance pure d’un mélange?
On peut examiner les propriétés de la substance comme :
-
-
-
-
* Les mélanges bouillent et gèlent à des températures différentes de celles des substances pures qui les composent.
Possible application de cette connaissance :
Questions Chapitre 1
Donne trois exemples de produits chimiques dangereux que l’on retrouve souvent à la maison. Explique pourquoi chacun est dangereux. (3 pts)
a. Si un produit porte une étiquette indiquant qu’il est inflammable, où devrait-on l’entreposer? (1 pt)
Qu’est-ce que les particules qui composent la glace et celles qui composent l’eau bouillante ont en commun? En quoi diffèrent-elles? (2 pts)
Deux substances sont décrites ci-dessous. À l’aide d’un tableau, classe chaque propriété selon qu’elle est physique ou chimique.
Un produit de débouchage – fluide épais, qui dissout les matières grasses, qui brûle la peau, de couleur bleu (2 pts)
|
Propriété chimique |
Propriété physique |
|
|
|
De l’hydrogène – plus léger que l’air, inodore, incolore, explose en présence d’étincelles. (2 pts)
|
Propriété chimique |
Propriété physique |
|
|
|
Classe chacune des substances suivantes selon que ses propriétés sont physiques ou chimiques. (3 pts)
Un clou rouillé
Le gaz kryton « flotte » au-dessus de l’air
Le sodium réagit violemment au contact de l’eau
Qu’arrive-t-il aux particules d’un liquide lorsque la température baisse? (1pt)
À l’aide d’un tableau, classe chacune des substances suivantes selon qu’elle est une substance pure ou mélange : du bicarbonate, du beurre d’arachides, de l’eau de Javel, de l’eau distillée, de l’huile à moteur, du sucre. Explique les raisons qui justifient cette classification. (3 pts)
-
Substance
Substance pure
Mélange
ex : air
X
bicarbonate
beurre d’arachides
l’eau de Javel
l’eau distillée
l’huile à moteur
sucre
Explique de quelle façon le sel agit sur les routes glacées au cours d’hiver. (2 pts)
Chapitre 2 : Les substances pures
Les éléments et les composés
2.1 : Assembler les pièces (p. 24 – 26)
Les premiers Grecs croyaient que toute la matière n’était composée que de quatre éléments :
Système de classification des éléments :
Le tableau périodique que l’on utilise encore aujourd’hui a été conçu par .
Les points communs des tableaux périodiques :
Ils ont tous l’apparence d’un schéma
Chacun des carrés du tableau comprend des renseignements à propos d’un élément.
Sur un tableau périodique :
Les colonnes représentent des .
Les rangées représentent des .
LES MÉTAUX ET LES NON-MÉTAUX
On peut faire la distinction entre les métaux et les non-métaux en étudiant leurs propriétés distinctes.
|
Métaux |
Métalloïdes |
Non-métaux |
|
Présentent une surface métallique (lustrés) Sont faciles à façonner ( ) Sont (à l’exception du mercure) Sont de conducteurs de chaleur et d’électricité Au côté du tableau périodique |
Mélange des deux propriétés |
Sont et de couleurs variées Sont . Sont (à l’exception du brome) Sont de conducteurs de chaleur et d’électricité Au côté du tableau périodique |
2.2 : Les éléments et les composés (p. 30 – 31)
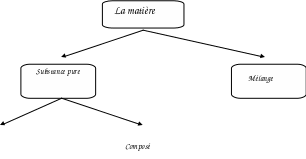
Élément :
Composé :
- peut être dissocié en substances plus simples
= réaction de décomposition
Par exemple...
L’oxygène = élément
L’eau distillée = composé formé de H et O
ALORS...
On peut classifier la matière comme :
2.3 : Les noms des éléments chimiques et leurs formules (p. 35-36)
Symbole de l’élément :
Les symboles sont pareils autour du monde.
Ex. carbone = C
Oygène = O
LES FORMULES CHIMIQUES :
Formule chimique :
1
Les lettres t’indiquent les qui composent une substance.
2
Les chiffres en indice t’indiquent la de ces éléments dans
une substance.
3
Une lettre en indice t’indique de la matière.
s – solide
l – liquide
g – gaz
aq – en solution
1

E

 x.
H2O
(l)
x.
H2O
(l)
3
2
* Si il n’y a pas de chiffre en indice qui suit le symbole de l’élément, ça indique qu’il y a seulement 1 molécule de cet élément.
Questions Chapitre 2
Quels sont les renseignements que te fournit chaque carré du tableau périodique? (5 pts)
Classe chacune des substances selon qu’elle est un métal ou un non-métal. (3 pts)
un gaz jaune tirant sur le vert
un solide de couleur argentée conducteur d’électricité
un liquide de couleur argentée très reluisant et conducteur d’électricité
3. Remplis le tableau ci-dessous. (5 pts)
|
Le nom de l’élément |
Le symbole |
La période |
Le groupe |
|
cadmium |
|
|
|
|
|
Zr |
4 |
1 |
|
|
|
1 |
1 |
|
oxygène |
O |
|
|
|
|
Nb |
5 |
|
4. Qu’arriverait-il si tu essayais de décomposer un élément? Justifie ta réponse. (2 pts)
5. Donne deux exemples d’éléments et deux exemples de composés. (2 pts)
6. À l’aide du tableau périodique, remplis les espaces vides du tableau ci-dessous. (2 pts)
|
Le symbole de l’élément |
Le nom de l’élément |
|
|
sodium |
|
Zn |
|
|
Cu |
|
|
N |
|
7. Écris la formule chimique du composé formé d’un atome d’azote et de deux atomes d’oxygène. (1 pt)
8. Suppose que l’on te remette l’échantillon d’un élément. Cet échantillon est d’un rouge foncé, d’apparence terne, fragile et friable. Cet élément est-il un métal ou un non-métal? Justifie ta réponse. (2 pts)
9. Remplis les espaces vides. (5 pts)
|
Le nom courant |
La formule chimique |
Le numéro et les noms des éléments |
Le nombre total d’atomes |
|
nicotine |
C10H1802(s) |
|
|
|
ibuprophène (Advil) |
C13H18O2(s) |
|
|
|
caféine |
C8H10N402(s) |
|
|
|
acétominophène (Tylenol) |
C8H9NO2(s) |
|
|
|
diazépam (Valium) |
C16H13ClN2O(s) |
|
|
Chapitre 3 : Les mélanges et leurs usages
3.1 : Deux types de mélanges (p. 42-43)


Élément






Mélange mécanique :
Exemples des mélanges mécaniques :
1)
2)
3)
Solution :
* Homogène : semble de contenir qu’un seul type de particule
Exemples de solutions :
1)
2)
3)
Les solutions sont constituées d’un soluté et d’un solvant.
Soluté :
Solvant :
Exemple :
|
Solvant |
+ |
Soluté |
= |
Solution |
|
De l’eau |
|
Cristaux de thé glacé |
|
Le thé glacé |
3.2 : Que sont la solubilité et la concentration? (p. 45-49)
Concentration :
Mesuré en masse ex. g
volume L
Indiqué sur les étiquettes de nombreux produits.
Solubilité :
Soluté
se dissout dans un solvant = soluble
Ex. le sel et
l’eau
Soluté
ne se dissout pas dans un solvant = insoluble
Ex.
l’huile et l’eau
* Quand on augmente la température, on augmente la solubilité.
Exemple pratique
À l’origine, le savon a été fabriqué à partir de animales mélangées avec la .
forme
une nouvelle substance capable à dissoudre ,
de
et
d’autres substances.
Les huiles, de la saleté et d’autres substances sont insolubles dans l’eau – le savon dissolvant la graisse et d’autres tâches pour nettoyer les vêtements.
3.3 : Séparer les mélanges (p. 50-55)
Pour pouvoir consommer de l’eau potable, on a besoin de purifier l’eau – on sépare l’eau pure des autres impuretés que l’eau contienne.
Ex. des minéraux
bactéries comme E. coli
L’eau impure est un exemple d’un mélange mécanique.
Cristallisation :
Comment est-ce qu’on purifie l’eau qu’on boit?
Étape 1 : encercle les particules de saleté dans l’eau de la même manière que le encercle les particules de saleté dans la lessive. Les particules de saleté s’ .
Étape 2 : Les particules alourdies coulent au fond des bassins, puis on les vide de l’eau rendue plus .
Étape 3 : Des en retiennent toutes les particules solides qui restent.
Étape 4 : Des produits chimiques comme le chlorure éliminent les
encore présentes.
Distillation :
Questions Chapitre 3
1. Classe chacune des substances suivantes selon qu’il s’agit d’un mélange mécanique ou
d’une solution. (3 pts)
le béton
l’air
l’eau du robinet
2. Décris un test que tu peux effectuer afin de déterminer si un mélange est une solution ou un mélange mécanique. (1 pt)
3. Décris une méthode qui te permet de rendre un soluté encore plus soluble. (1 pt)
4. Que signifie 12 g/L? (1 pt)
5. Quelle est l’information que te donne la concentration d’une substance? (1 pt)
6. Les colibris aiment l’eau sucrée ayant une concentration de 300g/L. Lorsque tu essaies de mélanger cette solution, une partie du sucre ne se dissout pas et reste au fond du contenant. Que peux-tu faire pour qu’une plus grande quantité de sucre se dissolve? (1 pt)
7. Décris la façon dont on pourrait utiliser chaque substance ou chacun des objets suivants pour séparer un mélange mécanique. (3 pts)
un
papier filtre
un aimant
8. Décris la méthode que tu pourrais utiliser pour séparer le sucre du vinaigre dans une solution composée de sucre et vinaigre. (2 pts)
9. Tu es en train de remplir une poivrière et tu en échappes une petite quantité dans le sucrier. Comment peux-tu séparer le poivre du sucre? (2 pts).
Chapitre 4 : Les solutions et l’environnement
4.1 : Utiliser des solutions concentrées afin de réduire les déchets (p. 60-62)
Produits concentrés :
Exemples des produits concentrés :
Solutions diluées :
ces solutions contiennent beaucoup d’eau.
Comment fabrique-t-on les produits concentrés?
On enlève une partie ou la totalité du solvant qu’ils contiennent.
D’habitude le solvant est .
Chaque jour, au Canada, chacun d’entre nous se débarrasse de kg d’ordures.
Environ % des déchets accumulés dans les sites d’enfouissement sanitaire sont des produits d’emballage sous forme de plastique, de carton et de métal.
Par contre, on a besoin des emballages pour protéger contre la , et la _____ des produits alimentaires.
4.2 : Les acides et les bases (p. 63-65)
Acide :
Base :
Neutre :
Les propriétés des acides et des bases :
|
Les acides |
Les bases |
|
Présentent un goût . Font virer au le papier de tournesol bleu. Réagissent aux . Possèdent un pH à 7. Sont corrosifs Neutralisent les . Sont conducteurs d’électricité |
Ont un goût . Font virer au le papier de tournesol bleu. entre les doigts. Possèdent un pH à 7. Sont corrosifs Neutralisent les . Sont conducteurs d’électricité. |
Indicateur :
Exemples des indicateurs naturels :
le lichen, le jus au chou, le thé, le jus de raisin
Papier de tournesol :
pH (pourcent d’hydrogène) :
L’échelle de pH mesure l’acidité des substances et s’étend de 0 à 14.
Les acides ont un pH inférieur à 7.
Les bases ont un pH supérieur à 7.
Substances situées au milieu de l’échelle sont neutres.
4.3 : Les acides et les bases en action (p. 70-72)
La cuisson au four :
Quelle
réaction permet aux crêpes, biscuits et gâteaux de
lever? Quelle
substance est le produit de cette réaction?
La cuisson :
Comment l’addition d’un acide aux légumes durant sa cuisson, change-t-elle la
réaction?
Comment l’addition d’une base aux légumes durant sa cuisson, change-t-elle la
réaction?
Les soins de santé :
Comment est-ce que les antiacides fonctionnent?
Neutralisation :
Les déodorants :
Comment est-ce que le bicarbonate de sodium enlève les odeurs dans votre
réfrigérateur?
Corrosion :
aussi connue comme la rouille
l’oxygène est la cause principale de cette réaction
les substances comme les pluies acides et le sel en accélèrent le processus.
Exemples de la corrosion :
1)
2)
Questions Chapitre 4
1. Ces deux diagrammes montrent la concentration d’une solution. Lequel montre une solution dont la concentration augmente? Justifie ta réponse. (1 pts)
|
|
|
2. Nomme deux avantages qu’il y a à acheter des produits concentrés plutôt que des produits dilués. (2 pts)
3. Ta cousine aime bien prendre son thé en y ajoutant une cuillère de sucre. Sa mère préfere y ajouter trois cuillères de sucre. Laquelle préfère la solution la plus concentrée? (1 pt)
4. On a testé une solution inconnue à l’aide du papier de tournesol. Le papier de tournesol rouge est devenu bleu et le papier de tournesol bleu est resté bleu. La substance en question est-elle un acide ou une base? (1 pts)
5. Classe les solutions suivantes selon qu’elles sont acides, alcalines, ou neutres. (5pts)
a. l’eau de Javel pour travaux ménagers, son pH étant de 12,4
b. l’urine, son pH étant de 6,0
c. du café noir, son pH étant de 5,0
d. de l’eau sucrée, son pH étant de 7
e. un blanc d’oeuf, son pH étant de 7,8
6. William souffre d’indigestion acide (des brûlures d’estomac). Il n’a pas sous la main un produit antiacide commercial, mais il a du bicarbonate de sodium. Ce produit peut-il lui être utile pour soulager ses brûlures d’estomac? Justifie ta réponse. (2pts)
7. On obtient du toffee en mélangeant du sucre, du sirop de maïs, du vinaigre et du bicarbonate de sodium. Qu’est-ce qui provoque la formation de bulles dans le toffee? (1 pt)
8. Pourquoi te faudrait-il laver une voiture que tu aurais conduite en hiver sur des routes ayant été salées? (2 pts)
9. Nomme deux facteurs qui agissent sur la corrosion. (2 pts)
_____________________________
_____________________________
Notes de cours
44 CHAPITRE 4 VANG ET IPG CHAPITRE 4
5 ENGLISH CHAPITRE 9 LOI MODIFIANT LA LOI DE
6 CHAPITRE N° 2 LES MOMENTS LES MOMENTS
Tags: chapitre 1, questions chapitre, chapitre, exercice
- PARTICIPACIÓN DE LOS ACTORES SOCIALES EN LAS OEA/SERE ACTIVIDADES DEL PROCESO DE CUMBRE DE LAS
- BOYLER HESABI ÖZET BOYLER HACMI KAPASITESI SICAK SU IHTIYACI
- IİMAR İŞLERI BIRIMI A) İMAR DURUM BÜROSU VE
- SOL·LICITUD PER CÈDULA D’HABITABILITAT DE SEGONA OCUPACIÓ() DADES DEL
- KODEKS ETYCZNY PRACOWNIKÓW URZĘDU MIASTA KIELCE PREAMBUŁA KODEKS ETYCZNY
- INSTITUTO DE ESTUDIOS DE POSTGRADO MÁSTERES UNIVERSITARIOS CURSO 20192020
- IMPORTING AND WORKING WITH RAW SEA ICE DATA FIELDS
- CRC SMOKE REPORT INFORMATION DATE TIME CALL
- PROCEEDINGS OF THE WORLD BANK ANNUAL CONFERENCE ON DEVELOPMENT
- WARSZAWA 7 GRUDNIA 2011R SZ P DONALD TUSK PREZES
- TABLE 4 SUMMARY OF RESULTS SERIESPERIOD COVERED OPTIONS SUMMARY
- UNCETDG21INF15 COMMITTEE OF EXPERTS ON THE TRANSPORT OF
- DARWINIAN EXPLANATIONS AND SOCIOCULTURAL PROCESSES A SYNTHESIS DANIEL NETTLE
- EMPLOYEE HANDBOOK TELECOM NETWORK SOLUTIONS PVT LTD CORPORATE OFFICE
- TYRIMO „AKADEMINIO SĄŽININGUMO INDEKSAS 2013“ PRISTATYMO MEDŽIAGA TYRIMU „AKADEMINIO
- 8 DON CARLOS GONZÁLEZGARCÉS SANTISO CONCEJALSECRETARIO DE
- IMAGINE A BETTER FUTURE WHAT ARE YOUR OVERALL FEELINGS
- IMPLANTACIÓN Y MANEJO DE VERDEOS DE INVIERNO JOSÉ
- SEGÚN EL “RANKING WEB” DEL CSIC EL CEF ES
- SMLOUVA O NÁJMU POZEMKŮ UZAVŘENÁ DLE OBČANSKÉHO ZÁKONA A
- 2 ORDEN DEL DÍA FIJADO POR
- AFRICAN AMERICAN COMMUNITIES AND MENTAL HEALTH FACT SHEET MENTAL
- A SZOCIÁLIS GONDOSKODÁS TÖRTÉNETE TÉTELEK 1ELEMEZZE AZ ÓKORI
- 3TECHNOLÓGIAI MEGOLDÁSOK FÖLDMUNKA FÖLDKIEMELÉS AZ ÖSSZES FÖLDKIEMELÉSI ÜTEM MARKOLÓGÉPPEL
- A RCHIVIO ATTREZZI PICCOLA PESCA RETI DA POSTA (COMPILARE
- (PARA PARTICIPANTES EN EL NIVEL ELEMENTAL) CON ESTE ESCRITO
- CHE 304 (SPRING 2010) LAST NAME FIRST PROBLEM
- SPECIALTY TRAINING COMMITTEE IN RESPIRATORY AND SLEEP MEDICINE
- ZDRUŽENJE ZA EKOLOŠKO KMETOVANJE SV SLOVENIJE OB BLAŽOVNICI 51
- MEDLIHER – MEDITERRANEAN LIVING HERITAGE CONTRIBUTION TO
SÚHLAS DOTKNUTEJ OSOBY (V ZMYSLE § 11 ZÁKONA Č
DOC DR ETELKA KORPIČHORVAT UREJANJE DELOVNIH RAZMERIJ PO ZAKONU
OPĆI PODACI OPĆI PODACI O OPĆINI MARČANA
RELACIONES ENTRE EL PENSAMIENTO Y EL LENGUAJE UN TEXTO
 POWERPLUSWATERMARKOBJECT3 PRACTICAS DE WINDOWS PROFESOR MSC LUIS DIEGO SANCHO
POWERPLUSWATERMARKOBJECT3 PRACTICAS DE WINDOWS PROFESOR MSC LUIS DIEGO SANCHOINTERNATIONAL MAPLE SYRUP INSTITUTE JANUARY 12TH 2016 THE BOARD
TENSE MEANINGUSES ENDINGS IRREGULARS STEM CHANGES SPELLING CHANGES SPECIAL
I KLASĖ EIL NR MOKINIŲ PASIEKIMAI (IŠ BP)NUOSTATOS ŽINIOS
5 CARNE Y PRODUCTOS CÁRNICOS EN 2003
EXAMENES RESUELTOS LITERATURA UNIVERSAL ROMEO Y JULIETA ENTRAN ROMEO
 ZAŁĄCZNIK NR 2 DO ZAPYTANIA OFERTOWEGO NR 22017 FORMULARZ
ZAŁĄCZNIK NR 2 DO ZAPYTANIA OFERTOWEGO NR 22017 FORMULARZMENTAL HEALTH PROFESSIONAL SHORTAGE AREAS (HPSA’S) CURRENTLY DESIGNATED IN
WAYNESBORO ECONOMIC DEVELOPMENT AUTHORITY REVOLVING LOAN PROGRAM THANK YOU
 NAZIV PRIJEVOZNIKA SJEDIŠTE (OPĆINAGRAD ULICA I BROJ) BROJ TELEFONA
NAZIV PRIJEVOZNIKA SJEDIŠTE (OPĆINAGRAD ULICA I BROJ) BROJ TELEFONA CONSULTORÍA NUTRICIONAL GALLEGA CONUGA WWWCONUGACOM MENÚS OUTONOINVERNO RESTAURANTE SALA
CONSULTORÍA NUTRICIONAL GALLEGA CONUGA WWWCONUGACOM MENÚS OUTONOINVERNO RESTAURANTE SALAJACEK KOSSUT CURRICULUM VITAE BORN 12031951
 FIAT LVX (SAŽETAK) ESEJI O DREVNOM I PRIHVAĆENOM ŠKOTSKOM
FIAT LVX (SAŽETAK) ESEJI O DREVNOM I PRIHVAĆENOM ŠKOTSKOM SCT161 PROV 2 PAGE 2 WIPO E SCT161 PROV2
SCT161 PROV 2 PAGE 2 WIPO E SCT161 PROV2 الجمهورية الجزائرية الديمقراطية الشعبية الجمهورية الجزائرية الديمقراطية الشعبية RÉPUBLIQUE
الجمهورية الجزائرية الديمقراطية الشعبية الجمهورية الجزائرية الديمقراطية الشعبية RÉPUBLIQUEALVARADO MAITE III PARATEXTO Y COMPRENSIÓN LECTORA (APUNTES) EN