A 2 KALIUMPERMANGANAT KALIUMPERMANGANAT FINDET ALS STARKES OXIDATIONSMITTEL SOWOHL
A 2 KALIUMPERMANGANAT KALIUMPERMANGANAT FINDET ALS STARKES OXIDATIONSMITTEL SOWOHL
A 2 Kaliumpermanganat
A 2 Kaliumpermanganat
Kaliumpermanganat findet als starkes Oxidationsmittel sowohl in der anorganischen als auch in der organischen Chemie Anwendung.
1. Dieses Salz enthält wie alle Kaliumverbindungen das Radioisotop K-40. Bei einem kleinen Teil der K-40-Nuklide findet eine K-Einfangreaktion statt; hierbei reagiert ein Elektron der K-Schale mit einem Nukleon. Der Großteil der K-40-Atomkerne stabilisiert sich durch ß--Zerfall.
1.1. Geben Sie für beide Kernreaktionen die Gleichungen an! Zeichnen Sie einen Ausschnitt einer beschrifteten Nuklidkarte und tragen Sie die beiden Kernreaktionen des K-40 ein! 5 BE
1.2. Eine Alternative zum K-Einfang ist der Positronenzerfall (ß+-Zerfall).
Geben Sie die Kerngleichung für den Positronenzerfall eines K-40-Atoms an und ermitteln Sie rechnerisch, ob der Positronenzerfall für K-40-Atomkerne prinzipiell eine Stabilisierungsmöglichkeit darstellt! (ma(K-40) = 39,963999 u) 4 BE
1.3 Laut Strahlenschutzverordnung darf im Unterricht mit K-40-Präparaten gearbeitet werden, sofern dieAktivität der Probe 1,0106 Bq nicht überschreitet. Die Halbwertszeit von K-40 betragt 1,28109 Jahre. Berechnen Sie die entsprechende Masse an reinem Kalium-40! 5 BE
2. Permanganat-lonen werden im Rahmen der Manganometrie z. B. zur titrimetrischen Konzentrationsbestimmung von Eisen(II)-lonen verwendet. Peroxodischwefelsäure H2S2O8 kann nicht direkt mit Kaliumpermanganat titriert werden. Es ist aber möglich, sie mit Eisen(II)-sulfat zu Schwefelsäure zu reduzieren. Die störende gelb-braune Eigenfarbe der entstehenden Eisen(III)-lonen kann durch Zugabe von Phosphorsäure maskiert werden; dabei entsteht ein farbloser Eisen(lll)-Komplex.
Erläutern Sie auf der Basis dieser Angaben eine Versuchsdurchführung. mit der es gelingt, den Gehalt einer Lösung an Peroxodischwefelsäure manganometrisch zu bestimmen! Geben Sie alle notwendigen Reaktionsgleichungen an! Hinweis: Die Bildung des Eisen(lll)-Komplexes muss nicht formuliert werden! 10 BE
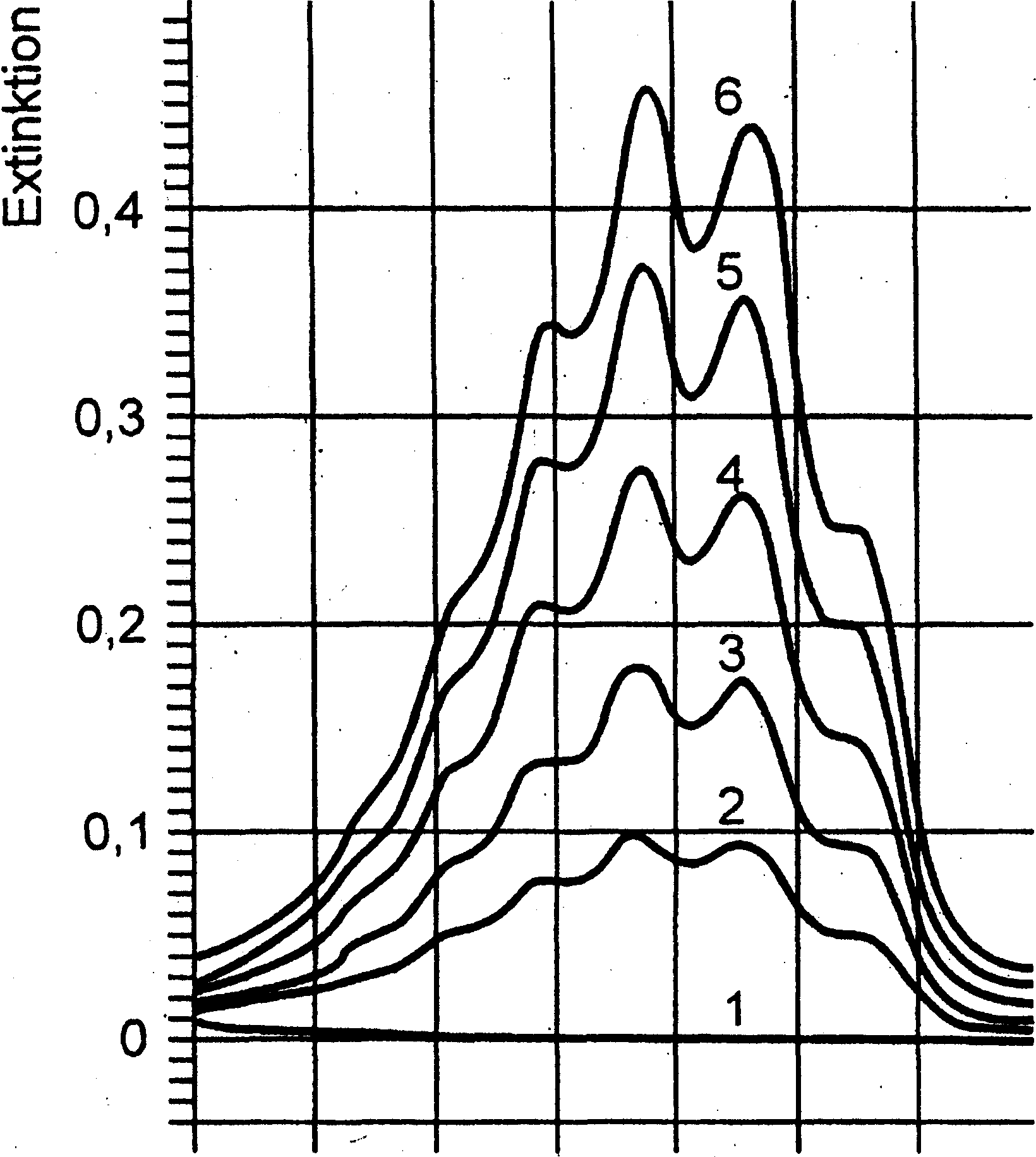
3. Die intensive Farbe des Permanganat-lons ermöglicht seine photometrische Konzentrationsbestimmung.
In der folgenden Grafik wird die Extinktion verschiedener Kaliumpermanganatlösungen in Abhängigkeit von der Wellenlänge des monochromatischen Lichtes und der Konzentration dargestellt:
-
Spektrum
c(KMn04)
1
0 mol/L (reines Lösungsmittel)
2
2•10-4 mol/L
3
4•10-4 mol/L
4
6•10-4 mol/L
5
8•10-4 mol/L
6
1•10-3 mol/L
Extinktionskurven von Kaliumpermanganatlösungen verschiedener Konzentration (verändert nach http://www.ruhr-uni-bochum.de/prak-ncdf05/UTRM/Dokumente/7_Photometrie.pdf, S. 80, aufgerufen am 04.04.2008)
450 500 550 [nm]
3.1. Beschreiben Sie das Funktionsprinzip eines Spektralphotometers! 4 BE
3.2. Erstellen Sie aus den gegebenen Spektren eine Eichgerade und ermitteln Sie grafisch die Konzentration einer Kaliumpermanganatlösung, die bei einer Wellenlänge von 520 nm eine Extinktion von 0,3 zeigt! 5 BE
3.3 Begründen Sie, warum das Spektrum 1 aufgenommen wird! 2 BE
4. Kaliumpermanganat wird bei der Baeyer-Probe verwendet. Beschreiben Sie die Durchführung der Baeyer-Probe mit Benzol, Cyclohexen und Cydohexan und die jeweiligen Beobachtungen! Begründen Sie im Fall eines negativen Verlaufs. weshalb keine Reaktion erfolgt! 5 BE
Gesamt: 40 BE
Tags: kaliumpermanganat kaliumpermanganat, 4. kaliumpermanganat, kaliumpermanganat, sowohl, findet, starkes, oxidationsmittel
- HTTPSERGIODELUZWORDPRESSCOM OFICINAS DE IBERCAJA ANDALUCÍA ALMERÍA RB OBISPO
- [HOSTELDAY CENTRE] ADDRESS ADDRESS ADDRESS POST CODE [DATE] TELEMAIL
- LA IMPORTANCIA DE LOS DERECHOS INTELECTUALES EN LA ECONOMÍA
- PUBLISHER PROGRAM TITLE COMPONENTS PUBLISHER PROGRAM TITLE COMPONENTS CALIFORNIA
- STANOVY KLUBU RARÁŠKŮ BÍLOVICELUTOTÍN I ÚVODNÍ USTANOVENÍ NÁZEV SÍDLO
- APRIL BREAKFAST DEXTER SCHOOL ◄ MARCH ~ APRIL 2019
- UNIVERSIDAD DE SALAMANCA SERVICIO GENERAL DE PREPARACIÓN DE ROCAS
- 6 C ENTRO DE CIENCIA BÁSICA UPB LABORATORIO FUNDAMENTOS
- 1 890 KJ IS RELEASED WHEN 1 MOLE OF
- PO ZAHODU ZDA IN HAVAJIH PRVO LETOŠNJE STROKOVNO IN
- LATE STAGE REVIEW (LSR) FORM BETWEEN 18 AND 24
- PAGE 3 OF 3 POLICY RAD2065 GUIDELINES RECOMMENDATIONS
- RUNNING RECORDS CONVENTIONS ACCURATE READING
- 18 RECTÁNGULO COORDINADOR MINISTERIO DE MEDIO AMBIENTE
- STRUCTURA PROIECTULUI DE MANAGEMENT ELEMENTELE CARE TREBUIE ABORDATE A
- INFORMACJA PRASOWA REKORDOWE WYNIKI ID LOGISTICS OPERATOR PODSUMOWUJE
- CONVOCATORIA REFERENCIA 152017 TRABAJADORA SOCIAL PROGRAMA DE ACOGIDA
- 3 FORMAI PRITARTA 2014–2020 M EUROPOS SĄJUNGOS STRUKTŪRINIŲ FONDŲ
- LA TABLA PERIÓDICA IES LA MAGDALENA AVILÉS ASTURIAS L
- UCHWAŁA NR 2012 RADY MIASTA STOŁECZNEGO WARSZAWY Z DNIA
- CALCULADORA GRÁFICA (TI82 TI83 Y TI83 PLUS) LA CALCULADORA
- GTBTNEGY28ADD1 0 NOTIFICATION ADDENDUM THE FOLLOWING COMMUNICATION
- APPENDIX TABLE STUDY DESIGN STRENGTHS AND WEAKNESSES STUDY
- CIF …………………………………………………………… MÃ KHÁCH HÀNG GIẤY ĐỀ NGHỊ THANH
- PROVINCIA DI FROSINONE DELIBERAZIONE DEL COMMISSARIO STRAORDINARIO
- EXAM IN COMPUTER ENGINEERING KURSKOD SMD137SMD082SMD066 TENTAMENSDATUM 20050818
- SOLICITUD DE MATRÍCULA CÓDIGO 61LH EL VALOR DE LA
- CIENCIAS NATURALES 2° MEDIO UNIDAD 1 OA1
- TRAINING REGULATIONS FOOD AND BEVERAGE SERVICES NC II TECHNICAL
- ZAŁĄCZNIK NR 1 DO UCHWAŁY NR 277VI2014 NACZELNEJ RADY
 PRISON SERVICE ORDER ORDER NUMBER 1030 VIDEO LINKS
PRISON SERVICE ORDER ORDER NUMBER 1030 VIDEO LINKSNA PODLAGI 2 ODSTAVKA 74 ČLENA ZAKONA O LOKALNIH
EKONOMI UTGIFTER NEDANSTÅENDE BEDÖMNINGAR HAR VI PRESENTERAT
 THE NATIONAL CAPACITY DEVELOPMENT ACTION PLAN 1 PURPOSE
THE NATIONAL CAPACITY DEVELOPMENT ACTION PLAN 1 PURPOSE WINTERHALTER QUARTZ DISHWASH POWDER (CONT’D) IDENTIFICATION OF PREPARATION AND
WINTERHALTER QUARTZ DISHWASH POWDER (CONT’D) IDENTIFICATION OF PREPARATION ANDNOVEMBER 17 2021 TABLE A 1 STANDARD FIN SPECIES
HI EVERYONE THIS IS THE EIGHTH OF THE WEEKLY
19 MANUAL DE TECNICA LEGISLATIVA POSGRADO INFORMACIÓN JURÍDICA Y
ADMINISTRATIVE LAW IN CONTEXT CHAPTER 9 A FINE ROMANCE?
 BAYESIAN METHODS FOR PARAMETER ESTIMATION AND DATA ASSIMILATION FOR
BAYESIAN METHODS FOR PARAMETER ESTIMATION AND DATA ASSIMILATION FOR LIC DIEGO NÚÑEZ PRIMEROS AUXILIOS PSICOLÓGICOS Y EMOCIONALES REVERSIÒN
LIC DIEGO NÚÑEZ PRIMEROS AUXILIOS PSICOLÓGICOS Y EMOCIONALES REVERSIÒNABSTRAK PENELITIAN INI MENGUJI KEBERADAAN DAY OF THE WEEK
PARQUES CIENTÍFICOS Y TECNOLOGICOS F51 OTROS GASTOS GENERALES
PILINSZKY JÁNOS ÁLTALÁNOS ISKOLA ÉS ALPFOKÚ MŰVÉSZETOKTATÁSI INTÉZMÉNY AZ
PIEŚNI POJEZIERZA KONKURS WYKONANIA PIEŚNI TRADYCYJNYCH Z POLESIA LUBELSKIEGO
NAME UPX COMPRESS OR EXPAND EXECUTABLE FILES SYNOPSIS
MEMORANDUM OF UNDERSTANDING BY AND BETWEEN AND TEXAS A&M
 DECLARATION OF ACCEPTANCE OF OFFICE I [ 1 ]
DECLARATION OF ACCEPTANCE OF OFFICE I [ 1 ]LBHT VERSION 0 LG 55 LUFTLEITUNGSEINBAUTEN 55 LUFTLEITUNGSEINBAUTEN
 COMMON CATEGORIES SHAPE ANDOR ORNAMENTATION SURFACE COLOUR W THE
COMMON CATEGORIES SHAPE ANDOR ORNAMENTATION SURFACE COLOUR W THE