QUÍMICA BIOLÓGICA 2010 QUÍMICA BIOLÓGICA T P 8 CROMATOGRAFIA
Hasta Ahora Hemos Estudiado a las Reacciones Químicas3 Lista de Exercícios 02 – Cinética Química Aplicada
6 Cinética Química Algumas Observações Relativas à Determinação da
Academia de Ciencias Matemáticas Físicoquímicas y Naturales de Granada
Cinética Química 1 Considera la Reacción de Orden Cero
Cinética Química abp Expedición a Cusco – Primera Parte
Química Biológica
Química Biológica 2010
Química Biológica
T P
8 CROMATOGRAFIA EN PAPEL
,
P
8 CROMATOGRAFIA EN PAPEL
,
Introducción
Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa “escribir con color” ya que la cromatografía fue empleada por primera para separar pigmentos. Existen numerosas variantes del método, pero el fundamento es común a todos los métodos:
Una Fase Móvil se mueve a través de una Fase Estacionaria arrastrando en su camino las moléculas de una muestra. Estas interaccionan de forma diferentes con las fases, por lo cual algunas avanzan rápido y otras mas lento, logrando así la separación
Los métodos cromatográficos pueden ser clasificados según:
El estado físico de la fase
El mecanismo de separación
El tipo de soporte.
La dirección de la corrida
Según el estado de las fases tenemos que la fase móvil puede ser un gas o un líquido, mientras que la estacionaria puede ser un líquido o un sólido. Se pueden establecer cuatro tipos de cromatografia: gas-líquido, líquido-líquido, gas-sólido, líquido-sólido.
Existen numerosos mecanismos de interacción entre los componentes de la mezcla y las fases del sistema cromatográfico. En algunos casos participan más de un mecanismo en un mismo proceso de separación por lo que dificulta la clasificación.
Los principales mecanismos que intervienen en la separación cromatográfica son:
Adsorción: Gases o líquidos contenidos en la fase móvil son retenidos por una adsorción selectiva en la superficie del sólido que constituye la fase estacionaria.. Este mecanismo controla la cromatografía gas-sólido y líquido-sólido. La muestra aplicada en la capa es adsorbida en la superficie del material por la acción de fuerzas electrostáticas (fuerzas de Van der Waals, puentes de Hidrógeno, efectos inductivos, etc).
Reparto: Los componentes de la fase móvil son retenidos por la fase estacionaria liquida en función de su solubilidad en ella. Si las dos son liquidas se tiene un proceso de extracción en continuo.
Intercambio Iónico: La fase estacionaria constituida por un sólido intercambiando iones con iones contenidos en la fase móvil, liquida. El intercambio de iones sólido-solución esta regulado por la afinidad química de los iones con ambas fases y por sus respectivas concentraciones.
Tamaño Molecular: Especies neutras de alto peso molecular pueden ser separadas en virtud de su tamaño donde la fase estacionaria es un gel hidrofílico altamente poroso que retiene las moléculas de menor tamaño al de los poros. Las moléculas de mayor tamaño son retardadas en su paso por pequeñas fuerzas de adsorción de la superficie externa del gel que luego son excluidas de la fase estacionaria.
Respecto al soporte son varias las formas que existen, se llama soporte inerte si no participa en la separación y soporte activo si participa en el proceso de separación. La dirección de la corrida puede ascendente, descendente o bidireccional.
La fase móvil puede ser un único solvente o bien una mezcla de ellos, lo cual permite lograr fases de polaridades intermedias. A continuación se muestra la serie eleutrópica de polaridad creciente de los solventes más comunes
ETER DE PETROLEO
HEXANO
TETRACLORURO DE CARBONO
BENCENO
CLORURO DE METILENO
CLOROFORMO
ETER ETILICO
ACETATO DE ETILO
ACETONA
PIRIDINA
ETANOL
METANOL
AGUA
Dentro de las múltiples variables encontramos la cromatografía en papel. Es una técnica de separación e identificación de sustancias químicas mediante un disolvente que se mueve sobre hojas o tiras de papel de filtro u papeles especialmente diseñados. La cromatografía en papel se utiliza para compuestos muy polares o polifuncionales. El uso más común es para azúcares, aminoácidos y pigmentos naturales La fase móvil se desplaza a través del papel, arrastrando los componentes de la mezcla a distintas velocidades En esta cromatografía se utiliza el fenómeno de reparto en donde la fase estacionaria se halla sobre un soporte activo (el papel) que en realidad forma parte de la fase estacionaria que es un complejo celulosa-agua
Parte experimental
Objetivos:
Separar mediante cromatografía de partición en papel los hidratos de carbono presentes en una muestra.
Separar mediante cromatografía de partición en papel los aminoácidos de una muestra dada.
Separación y detección de Hidratos de carbono
Extracción de la muestra
Exprimir 5 ml de jugo de naranja, limón o tomate.
Centrifugar a 3000 rpm por 3 minutos.
A 1 ml de sobrenadante agregar 3 ml de etanol para precipitar las proteínas y sales.
Centrifugar a 3000 rpm por 3 minutos
Preparación de la cuba
Colocar 1 cm aproximadamente de fase móvil acetato de etilo: piridina: agua (55:25:20). Esto permite saturar la cuba con vapores de la fase móvil para obtener un frente de corrida homogéneo
Siembra
Se aplican muestras en solución a no menos de 1,5 cm del borde inferior de una tira rectangular de papel, y a no menos de 1,5 cm de los bordes laterales, manteniendo a su vez, entre mancha y mancha una distancia no menor de 1 cm. Se hace un toque con el capilar, se evapora el solvente, se hace otro toque, tratando de concentrar la muestra sin superar un diámetro de la mancha de 3 mm. La siembra es puntual para fines analíticos, y en banda para fines preparativos.
Tomar un capilar para cada muestra a sembrar
Sembrar 3 gotas del extracto de jugo
Sembrar 3 gotas de una muestra problema.
Sembrar 3 gotas del standard de glucosa
Sembrar 3 gotas del standard de fructosa
Sembrar 3 gotas del standard de ribosa
Revelado:
Si los compuestos de la mezcla fuesen coloreados, las manchas serian visibles directamente. De lo contrario habrá que revelarlas. Algunos reveladores empleados son:
Luz UV: si los compuestos absorben esta radiación las manchas se verán con fluorescencia.
Reactivos de color: específicos para cada compuesto. Se deberá tener en cuenta que no se pueden usar reveladores que destruyan el papel como el ácido sulfúrico o el calor.
Vapores de yodo sublimado: es un revelador universal.
Revelador para Hidratos de carbono
Nitrato de plata 40% (para usar diluir 1:40 en acetona)
NaOH en etanol (1ml NaOH 1N + 20 ml etanol)
Tiosulfato de sodio 2,5 %
La reacción en medio alcalino es la siguiente:
Reacción principal: Ag+-------------Agº
Reacción secundaria Ag+-------------Ag2O
Los reactivos deben estar en solución no acuosa para no disolver los azúcares. Una vez esparcido el nitrato de plata, se deja secar y se lava con NaOH y se fija con Tiosulfato, para evitar que se desvanezcan las manchas y para solubilizar el exceso de oxido de plata.
Evaluación
La evaluación requiere el cálculo de la relación de frentes para cada muestra
Rf = distancia recorrida por la muestra / distancia recorrida por el frente
Separación y detección de aminoácidos
Extracción de la muestra
Exprimir 5 ml de jugo de naranja, limón o tomate.
Centrifugar a 3000 rpm por 3 minutos.
A 1 ml de sobrenadante agregar 3 ml de etanol para precipitar las proteinas y sales.
Centrifugar a 3000 rpm por 3 minutos
Preparación de la cuba
Colocar 1 cm aproximadamente de fase móvil etanol: agua: amoníaco (80:10:10). Esto permite saturar la cuba con vapores de la fase móvil para obtener un frente de corrida homogéneo
Siembra
Se aplican muestras en solución a no menos de 1,5 cm del borde inferior de una tira rectangular de papel, y a no menos de 1,5 cm de los bordes laterales, manteniendo a su vez, entre mancha y mancha una distancia no menor de 1 cm. Se hace un toque con el capilar, se evapora el solvente, se hace otro toque, tratando de concentrar la muestra sin superar un diámetro de la mancha de 3 mm. La siembra es puntual para fines analíticos, y en banda para fines preparativos.
Tomar un capilar para cada muestra a sembrar
Sembrar 3 gotas del extracto de jugo
Sembrar 3 gotas de una muestra problema.
Sembrar 3 gotas del standard de aspartico
Sembrar 3 gotas del standard de alanina
Sembrar 3 gotas del standard de lisina
Revelado
Si los compuestos de la mezcla fuesen coloreados, las manchas serian visibles directamente. De lo contrario habrá que revelarlas. Algunos reveladores empleados son:
Luz UV: si los compuestos absorben esta radiación las manchas se verán con fluorescencia.
Reactivos de color: específicos para cada compuesto. Se deberá tener en cuenta que no se pueden usar reveladores que destruyan el papel como el ácido sulfúrico o el calor.
Vapores de yodo sublimado: es un revelador universal.
Esparcir ninhidrina 0,2% en acetona sobre el papel y luego calentar a 100°C durante 15 minutos
Evaluación
La evaluación requiere el cálculo de la relación de frentes para cada muestra
Rf = distancia recorrida por la muestra / distancia recorrida por el frente
Actividades complementarias
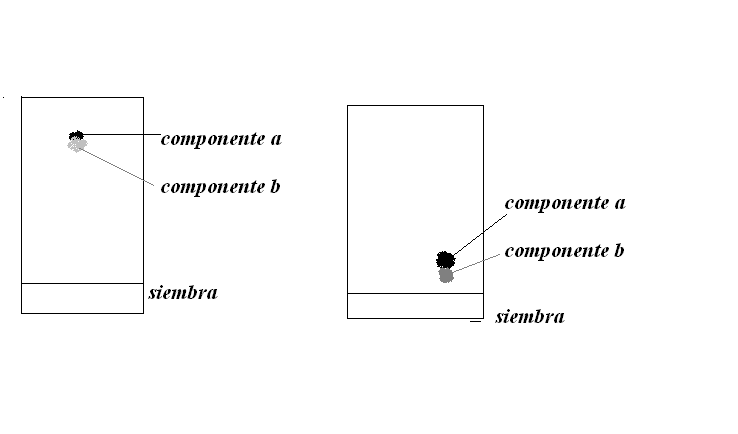
1- Se realizaron corridas cromatográficas para separar aminoácidos y se obtuvieron los siguientes resultados. ¿Qué recomendaciones harías para cambiar la resolución?
2. Determina cual de las siguientes fases móviles es la más polar:
a. etanol:agua (55 : 45)
b. etanol: agua: acetona (50 : 25 : 25)
c. etanol: agua ( 25 : 75)
3. Dada la siguiente fase móvil que éter etílico : hexano : acetona (50 : 45 : 5) ¿Qué compuestos podrían separase con ella?
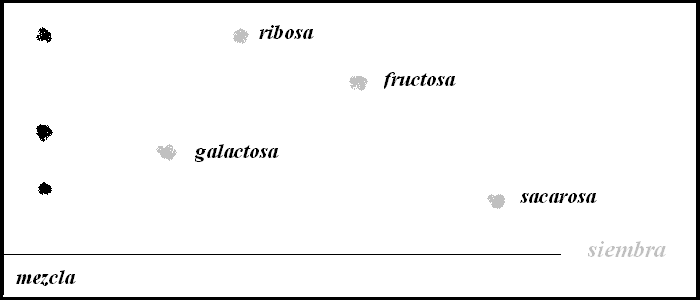
Calcula los Rf e identifica los azucares contenidos en la mezcla
Cinética Química ies la Magdalena Avilés Asturias la Cinética
Cinetica Química uno de los Modelos que Explican Cómo
Ejercicios Selectividad Zaragoza Cinética Química Junio 2008 Opción
Tags: biológica 2010, química, biológica, cromatografia
- MASTER’S MESSAGE BROTHERS I WOULD LIKE TO THANK YOU
- CONCURSOS BIZKAIA 1 PROYECTO SUMINISTRO E INSTALACIÓN DE JUEGOS
- REMEMBER (REVELATION 26) E B A REMEMBER REPENT
- ARTICULO DE INTERES EN ESTA EDICION MOSTRAMOS UN METAANÁLISIS
- NOTES FROM THE BOOK THE GREAT GOOD PLACE BY
- DIARIO LA PRENSA WWWLAPRENSAHNCOM DIARIO EL HERALDO WWWELHERALDOHN DIARIO
- GISR 2012 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ TITOLO DELL’ABSTRACT TITOLO DELL’ABSTRACT TITOLO DELL’ABSTRACT
- EK 4 BAŞVURU BELGELERİ 1 BAŞVURU FORMU (TURQUALITY®
- COMUNICADO DE OFICINA DE CONTRATACION DE LA ESE HCUP
- NIEPRAWID³OWY NUMER ID
- DON XXXXXXXX SUBTENIENTEBRIGADASARGENTO PRIMERO DEL CUERPO DE XXXXXXX ESCALA
- TRANSCRIPT OF CYBERSEMINAR PATIENTALIGNED CARE TEAM DEMONSTRATION LABS MAKING
- SECRETARIA DE MEDIO AMBIENTE RECURSOS NATURALES Y PESCA 1
- TC HARRAN ÜNİVERSİTESİ REKTÖRLÜĞÜ AB OFİSİ HAYATBOYU ÖĞRENME PROGRAM
- PÁGINA 2 AVISO NO 72005 ORGANIZACIÓN MUNDIAL DE LA
- FINALITAT A TRAVÉS D’AQUEST SERVEI TENIU LA POSSIBILITAT D’ACONSEGUIR
- UZAKYOL VARDİYA MÜHENDİSİ MAKİNİSTİ GEMİ İNŞA 1 AŞAĞIDAKILERDEN
- LA GACETA N° 213 – MARTES 03 DE NOVIEMBRE
- TELEFONOS Y PÁGINAS WEB DE INTERÉS TELÉFONOS DE INTERÉS
- ЗАТВЕРДЖЕНО РІШЕННЯ МІСЬКОЇ РАДИ ВІД 20122018 №7582735 ПОЛОЖЕННЯ ПРО
- PLANO INDEPENDENT SCHOOL DISTRICT SCHOOL HEALTH RESPIRATORY CARE ORDERS
- 4 TD 5376477 OPINIÓN Nº 1162014DTN ENTIDAD MINISTERIO DE
- FORMULARZ ZGŁOSZENIA INSTALACJI WYTWARZAJĄCYCH POLA ELEKTROMAGNETYCZNE I WYPEŁNIA PODMIOT
- ACTIVIDADES DE MATEMÁTICAS PARA 4º CURSO DE PRIMARIA DEL
- CUMPLIMIENTO DE NORMATIVA DE APLICACIÓN …………………………………………………………………… ARQUITECTO COLEGIADO Nº
- CONTRATO DE EDICIÓN EN ALICANTE A …………… DE 2017
- WEST EXPRESS SWIM TEAM – SHARKS PRACTICE SCHEDULE FOR
- LOS FONDOS ROCOSOS Y LAS PRADERAS DE POSIDONIA CONSTITUYEN
- S EGURIDAD ALIMENTARIA 2 (AGRICULTURA Y MEDIOS DE VIDA)
- REFORMACE VE FRANCII – NÁBOŽENSKÉ VÁLKY (16STOL) ŠÍŘENÍ LUTHEROVÝCH
 LIETUVOS RESPUBLIKOS ĮSTATYMAS DĖL UŽSIENIEČIŲ TEISINĖS PADĖTIES 2004 M
LIETUVOS RESPUBLIKOS ĮSTATYMAS DĖL UŽSIENIEČIŲ TEISINĖS PADĖTIES 2004 M REGIONAL POBLADORES DE SELVA ¿CONSUMIDORES DE SEGUNDA CATEGORÍA? CON
REGIONAL POBLADORES DE SELVA ¿CONSUMIDORES DE SEGUNDA CATEGORÍA? CON(2003047257) UCHWAŁA NR 221XV2003 RADY MIASTA RYBNIKA Z
BUPATI BANTUL PERATURAN BUPATI BANTUL NOMOR 08 TAHUN 2008
 K U R S G U I D E
K U R S G U I D E TEMA 2 IDENTIFICACIÓN Y CODIFICACIÓN DE RESIDUOS EJERCICIO 1
TEMA 2 IDENTIFICACIÓN Y CODIFICACIÓN DE RESIDUOS EJERCICIO 1G ELEMENTARY TEACHER’S RECOMMENDATION ENTERING 1ST – 6TH CONFIDENTIAL
Aviso Legal Datos de la Empresa en Cumplimiento
QUESTIONS TO SUPPORT AND SERVICE UNITS 1 DESCRIBE THE
FAVERSHAM CREEK CONSORTIUM MANAGEMENT GROUP MINUTES OF MEETING HELD
 CONGRESO REGIONAL CULTURA ESCRITA Y POLÍTICAS PEDAGÓGICAS EN LAS
CONGRESO REGIONAL CULTURA ESCRITA Y POLÍTICAS PEDAGÓGICAS EN LAS LINEE GUIDA PER I REDATTORI SBA – MAGGIO 2009
LINEE GUIDA PER I REDATTORI SBA – MAGGIO 2009 TRIBUNAL ADUANERO NACIONAL EXPEDIENTE N° 2332011 SENTENCIA N° 1762011
TRIBUNAL ADUANERO NACIONAL EXPEDIENTE N° 2332011 SENTENCIA N° 1762011 JOB DESCRIPTION JOB TITLE CARE MANAGER SALARY SCALE £25K£30K
JOB DESCRIPTION JOB TITLE CARE MANAGER SALARY SCALE £25K£30KHIRDETMÉNY A HATVANI JÁRÁSI HIVATAL FÖLDHIVATALIFÖLDÜGYI OSZTÁLYA (TOVÁBBIAKBAN FÖLDHIVATAL)
 381828DOC PAGE 14 OF 14 TITLE COMPARING DIFFERENT APPROACHES
381828DOC PAGE 14 OF 14 TITLE COMPARING DIFFERENT APPROACHES REAL FEDERACION ESPAÑOLA DE BALONMANO AREA DE COMPETICIONES Y
REAL FEDERACION ESPAÑOLA DE BALONMANO AREA DE COMPETICIONES Y TEL BEERSHEBA Y EL ALTAR TEL BEERSHEBA (TAMBIÉN
TEL BEERSHEBA Y EL ALTAR TEL BEERSHEBA (TAMBIÉNMOSQUITO REGISTERED TRAINING FACILITY INTRODUCTION AMENDMENT RECORD AMENDMENT NUMBER
 DIRECTIONS TO THOMSON REUTERS USING PUBLIC TRANSPORT DIRECTIONS TO
DIRECTIONS TO THOMSON REUTERS USING PUBLIC TRANSPORT DIRECTIONS TO