INDICE TRIAL MASTER FILE CODICE CLINICAL TRIAL OFFICE CTOSOP013
AFECCIONES OTOAUDITIVAS DE ORIGEN OCUPACIONAL INDICEINDICE DE CONTENIDOS INDICE DE CONTENIDOS 2 PANORAMA
LISTADOS VENTAS 012009 INDICE 2 INDICE 3
0 Y4 INDICE PRESENTACIÓN 3 INTRODUCCIÓN 4 I MARCO
1 INDICE DE PRECIOS INDUSTRIALES BASE 1990 CARACTERÍSTICAS TÉCNICAS
106 INDICE DE CONTENIDO INTRODUCCION 2 1 SECTORES
|
|
INDICE TRIAL MASTER FILE |
CODICE |
|
Clinical Trial Office |
CTO/SOP/013 rev.1-ALL1 |
Informazioni Studio
|
Codice Protocollo: |
|
|
Codice EudraCT: |
|
|
Titolo Studio: |
|
|
Sperimentatore Principale: |
|
|
Sezione |
Documenti |
|
0.0 |
Indice Una copia dell’indice utilizzato per lo studio deve essere presentata in questa sezione |
|
|
|
|
1.0 |
Centro coordinatore (Central Trial Coordination Team) Questa sezione fa riferimento ai documenti relativi alla formazione del team, all'esperienza e al training continuo durante tutta la durata dello studio. |
|
|
Lista contatti |
|
|
|
|
|
CV datati e firmati Certificati dei training GCP |
|
|
Training Log |
|
2.0 |
Protocollo - Emendamenti al Protocollo |
|
|
Emendamenti al Protocollo Scheda Raccolta Dati Altro |
|
3.0 |
Documenti relativi al prodotto sperimentale (Investigational Medicinal Product, IMP) Tutti i documenti relativi alla gestione del Investigational Medicinal Product (s) (IMP), tra cui confronto, placebo e non-IMP, se applicabile. I documenti possono essere archiviati fuori dal TMF durante lo studio, ma questo deve essere confermato in una nota nel TMF. |
|
|
Investigator’s Brochure (IB) o Riassunto Caratteristiche del Prodotto (RCP) |
|
|
Copia dell’etichetta per confezionamento primario e secondario |
|
|
Modulo di richiesta IMP |
|
|
Certificato di analisi del prodotto (se applicabile) |
|
|
Documentazione relativa all’approvvigionamento IMP (es. DDT) |
|
|
Documentazione relativa alla spedizione dell’IMP (se applicabile) |
|
|
Documentazione relativa allo stoccaggio |
|
|
Documentazione relativa al ritiro/ quarantena/ distruzione dell’IMP |
|
|
Accordi con il produttore/ distributore (se applicabile) |
|
|
Corrispondenza con il produttore/ distributore (se applicabile) Registro movimentazione farmaco sperimentale Drug Accountability Log Temperature Log |
|
4.0 |
Informazioni per i soggetti partecipanti allo studio Questa sezione è per i documenti relativi all’informativa e consenso per la partecipazione alla sperimentazione |
|
|
Foglio informativo e modulo di consenso informato (per genitori/tutori legali e pazienti, suddivisi per fasce di età) Consenso al trattamento dei dati personali Lettera al medico curante
Altri documenti per i partecipanti (questionari, diari giornalieri) |
|
5.0 |
Autorità Competente (AIFA) Questa sezione è riservata a tutti quei documenti da presentare all’ autorità competente. L’invio dei documenti è quasi esclusivamente in formato elettronico, ma i documenti devono comunque essere stampati e raccolti nel TMF. |
|
|
Lettera di intenti Autorità Competente Lettera di intenti per emendamento Clinical trial authorisation application (CTA) (Appendice 5- DM 21 Dicembre 2007) Domanda di autorizzazione di un Emendamento sostanziale (Appendice 9 - DM 21 Dicembre 2007) |
|
|
Corrispondenza |
|
6.0 |
Comitato Etico Tutti ii documenti relativi alla richiesta di parere del Comitato Etico |
|
|
|
|
|
Dichiarazione Conflitto di Interessi Dichiarazione sulla natura indipendente dello studio Domanda di autorizzazione di un Emendamento sostanziale (Appendice 9) Corrispondenza |
|
7.0 |
Autorizzazioni e Pareri Autorizzazione dell’Autorità Competente e parere del Comitato Etico per la conduzione dello studio (compresi i pareri e prese d’atto per emendamenti). |
|
|
Autorizzazione dell’Autorità Competente Parere del Comitato Etico Parere emendamenti Disposizione dirigenziale Corrispondenza |
|
8.0 |
Aspetti Finanziari Documenti finanziari e accordi economici |
|
|
Polizza assicurativa |
|
|
Convenzione economica (compresi eventuali accordi di trasferimento dati o materiale) |
|
|
Documenti relativi al finanziamento (se applicabile) |
|
|
|
|
|
Altro |
|
9.0 |
Randomizzazione Tutti i documenti relativi alla gestione del sistema di randomizzazione |
|
|
Lista di randomizzazione Procedure di apertura del cieco (se applicabile) Altri documenti relativi al sistema di randomizzazione |
|
10.0 |
Farmacovigilanza Tutti i documenti relativi alla segnalazione degli eventi avversi |
|
|
Scheda di segnalazione (SAE form) Dichiarazione di affidamento delle attività di farmacovigilanza SUSAR Notifiche relative alle informazioni di sicurezza |
|
|
Rapporti annuali di sicurezza (DSUR) |
|
|
Altro |
|
11.0 |
Laboratori clinici Tutti i documenti relativi al Laboratorio clinico per tutta la durata dello studio. |
|
|
Valori normali/range per le procedure mediche/strumentali/di laboratorio e/o gli esami compresi nel protocollo |
|
|
Procedure/esami medici/strumentali/ di laboratorio: - certificazione o - accreditamento o - controlli di qualità e/o accertamenti di qualità esterni o - altre validazioni (se richieste) |
|
|
Etichette campioni (se applicabile) |
|
|
Documenti invio/ricevimento campioni (se applicabile) CV del Direttore del laboratorio |
|
12.0 |
Data Management Documenti relativi alla gestione dello studio. |
|
|
|
|
|
Report delle deviazioni al protocollo |
|
|
Accountability (gestione quantitativa dell’IMP) Appendice 10 - DM 21 Dicembre 2007 Appendice 11 - DM 21 dicembre 2007 Appendice 12 - DM 21 Dicembre 2007 Clinical study report |
|
13.0 |
Monitoraggio |
|
|
Organizzazione e pianificazione del monitoraggio /Piano di valutazione del rischio Documenti relativi alla visita pre-studio (report, corrispondenza etc) Documenti relativi alla visita di inizio studio (report, corrispondenza etc) |
|
|
Documenti relativi alle visite periodiche (report, corrispondenza etc) Documenti relativi alla visita di chiusura (report, corrispondenza etc) Monitoring Visit Log (registro delle visite di monitoraggio) Informed Consent Log (registro per il controllo dei consensi informati firmati) Documenti relativi al Data Monitoring Committee (se applicabile) |
|
14.0 |
Assicurazione Qualità e Audit Tutti i documenti relativi alle attività di audit. |
|
|
Report degli audit Certificati degli audit |
|
|
Corrispondenza |
Trial
Master File Indice Pagina
121 TRANSFORMADORES DE CORRIENTE INDICE ESPECIFICACIONES TECNICAS PARTICULARES
16 SENSACIÓN Y PERCEPCIÓN INDICE 1 DEFINICIÓN Y
19 CELDAS DE MEDIA TENSIÓN INDICE ESPECIFICACIONES TECNICAS PARTICULARES
Tags: trial master, corrispondenza trial, trial, indice, clinical, master, office, ctosop013, codice
- 6 RIOPREVIDÊNCIA O FUNDO ÚNICO DE PREVIDÊNCIA SOCIAL DO
- TRICHINELLOSIS ACTIVITIES IN 2009 TRICHINELLOSIS DR EDOARDO POZIO
- ANEXO II PROGRAMA DE LIBERACIÓN COMERCIAL ANEXO II PROGRAMA
- BUMERANGS QUE RETORNEN PER JORDI BADOSA ELS PRIMERS BUMERANGS
- RA10 TÉCNICAS ESTADÍSTICAS DEPARTAMENTO DE MATEMÁTICAS RA10 TÉCNICAS ESTADÍSTICAS
- PROVA DO CONCURSO PARA O CHO 2004 FL
- 20160416 HAMNREGLER FÖR HÖNÖ KLÅVA FISKEHAMN EKONOMISK FÖRENING 7572031032
- LINKLISTE BRANCHENSPEZIFISCHE BGHANDLUNGSHILFEN AUF DER GRUNDLAGE DES SARSCOV2ARBEITSSCHUTZSTANDARD DER
- FORM BERITA ACARA PENYERAHAN BARANG DARI PENELITIPENGABDI KEPADA LPPM
- OBRAZAC 1 I Z J A V A O
- 2 MEETING DATE 80410 (1) ORDINANCE NO
- CONSULADO GENERAL DE ESPAÑA EN SANTO DOMINGO MODELO DECLARACION
- MY PROJECT ON MEDIEVIL CASTLES MY PROJECT IS ON
- TEHNISKĀ SPECIFIKĀCIJA CENU APTAUJAI „AUTORIEPU ATJAUNOŠANA” IDENTIFIKĀCIJAS NUMURS ASDS201948
- DEBT ISSUER’S ANNUAL QUESTIONNAIRE ISSUER FINANCIAL YEAR LR REF
- WATER RESOURCES CONTROL BOARD DIVISION OF FINANCIAL ASSISTANCE
- PLIEGO DE BASES TÉCNICAS PARA LA CONTRATACIÓN DE LA
- 15 STATEMENTS OF SIGNIFICANCEREASONS FOR LOCAL LISTING SEVENOAKS SITES
- AL MINISTERIO DE ECONOMÍA Y HACIENDA AL INSTITUTO NACIONAL
- COMENTARIOS AL BORRADOR DE OBSERVACIÓN GENERAL Nº 4 SOBRE
- … ………………CO WARTO WIEDZIEĆ NA TEMAT AUTYZMU……………… SAMO SŁOWO
- ZAŁĄCZNIK NR 2 DO ZARZĄDZENIA NR 20 REKTORA PP
- (1) CONSTRUCTION OF NEW GODOWNS NEW GODOWNS OF 8340
- TOWER HAMLETS CHILDRENS SERVICES DIRECTORATE GUIDANCE ON THE MISSING
- ` STUDENT HANDBOOK 55 MOSLEY STREET MANCHESTER M2 3HY
- G016 FREEFORM 1051 DESCRIBING IMAGES 4 PHOTOGRAPHS ILLUSTRATIONS AND
- SPOROČILO ZA JAVNOST ŠT 150816 STRANI 3 ŽIVAHNA TURISTIČNA
- 120 APPENDIX D CONCENTRATED ANIMAL FEEDING OPERATION (CAFO) REGULATIONS
- MUTASSA BE MILYEN TESTI ÉS LELKI VÁLTOZÁSOKON MEGY KERESZTÜL
- la Coherencia y Cohesión son Propiedades Textuales que Convierten
KAIROS – EDAD CONTEMPORÁNEA LA ÉPOCA DEL IMPERIALISMO EL
 REPÀS DE LA GRÀFICA D’UNA FUNCIÓ RACIONAL 1 DONADA
REPÀS DE LA GRÀFICA D’UNA FUNCIÓ RACIONAL 1 DONADA GUIA Nº 7 “LA FUENTE” 2° AÑO DE ENSEÑANZA
GUIA Nº 7 “LA FUENTE” 2° AÑO DE ENSEÑANZA HRVATSKE VODE PRAVNA OSOBA ZA UPRAVLJANJE VODAMA ULICA
HRVATSKE VODE PRAVNA OSOBA ZA UPRAVLJANJE VODAMA ULICACISCO NETWORKING ACADEMY LEHMAN COLLEGE OFFICE OF CONTINUING
 P LAN D’ÉVACUATION EVACUATION PLAN CLUB DE
P LAN D’ÉVACUATION EVACUATION PLAN CLUB DE BRONNEN UIT DE EERSTE WERELDOORLOG EEN LESSENREEKS EN TENTOONSTELLING
BRONNEN UIT DE EERSTE WERELDOORLOG EEN LESSENREEKS EN TENTOONSTELLINGBIBLIOGRAFÍA BÁSICA SOBRE LA CAUSA EN LOS ACTOS JURÍDICOS
 SECTION VII (PREVIOUSLY SECTION VI OF OREGON OSHA’S TECHNICAL
SECTION VII (PREVIOUSLY SECTION VI OF OREGON OSHA’S TECHNICAL MUNICIPALIDAD DE TORNQUIST SECRETARÍA DE OBRAS Y SERVICIOS
MUNICIPALIDAD DE TORNQUIST SECRETARÍA DE OBRAS Y SERVICIOSIF THE WORLD WERE A VILLAGE OF 100 PEOPLE
ELS VERBS IRREGULARS 1 IRREGULARITATS ORTOGRÀFIQUES 1A CONJUGACIÓ
YÖNETİM KURULU ADAYLIĞI BEYANI SERMAYE ŞIRKETLERININ GENEL KURUL
 STUDENT HANDOUT ECG & HEART SOUNDS INTRODUCTION THE
STUDENT HANDOUT ECG & HEART SOUNDS INTRODUCTION THEVeni Creator Spiritus (komm Schöpfer Heiliger Geist) – Spiritualität
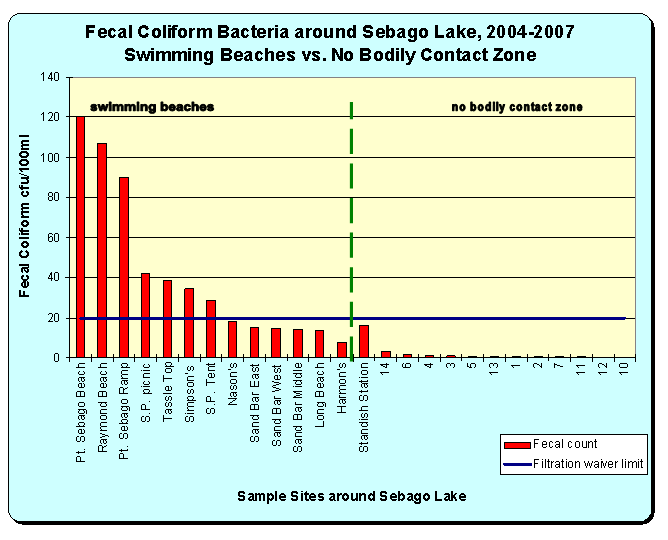 MAINE WATER UTILITIES ASSOCIATION POSITION PAPER PROPOSED SITING CRITERIA
MAINE WATER UTILITIES ASSOCIATION POSITION PAPER PROPOSED SITING CRITERIA ÖĞRETMEN MASASI YAZI TAHTASI M
ÖĞRETMEN MASASI YAZI TAHTASI M DE LA EUTANASIA LA ETICA LA LIBERTAD LA AUTONOMIA
 CHUYỆN HÔN NHÂN NỮ HOÀNG ELIZABETH II VÀ HOÀNG
CHUYỆN HÔN NHÂN NỮ HOÀNG ELIZABETH II VÀ HOÀNGAVISO LEGAL DE WWWCIRUGIADOCTORGASOSES © DOCUMENTO PROTEGIDO POR COPYRIGHT