Z GRAFU VYPLÝVA 1 CHEMICKÁ KINETIKA A SA ZAOBERÁ
MAGYAR ITF TAEKWONDO SZÖVETSÉG (MITSZ) HARDCONTACT VERSENYSZABÁLYZAT IPARAGRAFUS –NEORIENTOVANÉ A ORIENTOVANÉ GRAFY JEJICH REPREZENTACE PROHLEDÁVÁNÍ GRAFU (DO
PADRE NUESTRO ( MÚSICA SIMÓN & GRAFUNKEL ) PADRE
SORTOWANIE TOPOLOGICZNE SORTOWANIE TOPOLOGICZNE DIGRAFU POLEGA NA WYGENEROWANIU
STRUČNÝ NÁVOD NA OBSLUHU DIGITÁLNÍHO TACHOGRAFU TYP SIEMENS VDO
WYMAGANE PARAMETRY TECHNICZNE DANE OGÓLNE PEŁNA NAZWA ULTRASONOGRAFU PODAĆ
Z grafu vyplýva

![]()
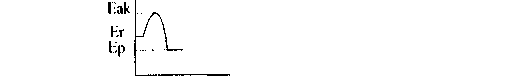

1. Chemická
kinetika
sa zaoberá rýchlosťou chemických reakcií
sa zaoberá tepelnými efektami chemických reakcii
sa zaoberá aj faktormi, ktoré ovplyvňujú rovnováhu
umožňuje spomaliť priebeh nežiadúcich chem. reakcií
2. Aby mohli dve častice zreagovať
musia sa zraziť
musia mať väčšiu energiu, ako je energia odpudivých síl ich jadier
musia byť vhodne priestorovo orientované
musia vytvoriť nestály energeticky bohatý medziprodukt
3. Aktivačná energia
minimálna energia potrebná na začatie reakcie
je energia aktivovaného komplexu
sa rovná rozdielu energie reaktantov a energie aktivovaného komplexu
sa uvoľní pri vzniku väzby
A2 + B2 - 2AB
objekt za druhou šípkou je aktivovaný komplex
za prvou šípkou sú produkty
bez aktivovaného komplexu
5.
4. Uvedená schéma znázorňuje priebeh reakcie
A H= Er - Ep
Aktivačná energia je Eak - Ep
F.p - Hr je reakčné teplo
d) graf znázorňuje endotermickú reakciu
6. Pre reakciu A2 + B – A2B piati
v=k.[A]2[B]
v= k . [2A]. [B]
v=k.[A2].[B]
v= k . [A2+ [B]
7. Vyberte správne tvrdenie
Reakcie, ktoré pri bežných podmienkach prebiehajú rýchlo, majú nízku aktivačnú energiu
Reakcie, ktoré majú nízku aktivačnú energiu pri bežných podmienkach prebiehajú rýchlo
1 lodnota aktivačnej energie závisí od reakčného tepla
Rýchlosť každej reakcie s pribúdajúcim časom klesá
8. Vyberte správne tvrdenie
inhibítory zmenšujú rýchlosť chemickej reakcie pretože znižujú hodnotu aktivačnej energie
zväčšením teploty sa zväčší aktivačná energia
rýchlosť reakcie závisí od koncentrácie produktov
rýchlosť reakcie závisí od veľkosti povrchu reagujúcich častíc
9. Katalyzátory
môžu zmenšovať rýchlosť chem. reakcie
môžu zväčšovať rýchlosť chem. reakcie
zdvojnásobia množstvo produktov
strojnásobia množstvo produktov
10. Pridanie katalyzátora do reakčného systému spôsobí
zväčšenie rýchlosti len endotermických reakcií
zmenšenie aktivačnej energie
zväčšenie rýchlosti pohybu častíc
zväčšenie počtu účinných zrážok
i
že sa jedná o endotermickú reakciu
rozdiel energií Epk-Ep je aktivačná energia
rozdiel energií Er-Ep je energia, ktorá sa uvoľní
rozdiel energií Er-Ep je entalpia
2- Z grafu reakcie vyplýva
energia sa pri reakcii uvoľňuje
rozdiel energií Epk-Er je aktivačná energia
rozdiel energií Ep-Epk je entalpia
že sa jedná o endotermickú reakciu
3. Chemická reakcia
je zmena látok, pri ktorej zanikajú väzby v produktoch a vznikajú väzby v reaktantoch
je obyčajne sprevádzaná uvoľňovaním alebo spotrebou energie
rozloženie valenčných elektrónov sa mení
menia sa jadrá atómov
4- Z grafu reakcie vyplýva
ze je to exotermicka reakcia
rozdiel energií Ep-Er je aktivačná energia
rozdiel energií Er-Ep je reakčné teplo
rozdiel energií Ep-Epk je entalpia
5. Chemické reakcie
podľa tepla rozdeľujeme na exotermické a endotermické
sú zmeny látok (ich podstaty)
môžu prebiehať aj samovoľne
prebiehajú len pri dodaní energie
6. CuS04 + 4 H20 - [Cu(H20)JS04
je syntéza
je analýza
je konverzia
je substitúcia
7. HgO-2Hg+02
je analýza
je syntéza
je substitúcia
je konverzia
8. [Cu(H20)4]S04 + 4 NH3 - [Cu(NH3)4S04 + 4 H20
je analýza
je syntéza
je substitúcia
je konverzia
9. Pb(N03)2 + 2 KI - Pbl2 + 2 KN03
je syntéza
je analýza
je konverzia
je substitúcia
:(). Chemickú reakciu považujeme za oxidoredukčnú
ak v nej atómy menia oxidačné čísla
ak medzi atómami dochádza k výmene elektrónov
ak len jeden atóm mení oxidačné číslo
ak atómy zanikajú alebo vznikajú
nedochádza k zmenám
v rozložení valenčných elektrónov
reagujúcich častíc
30. Reakčné
teplo Q b) druh
látok sa nemení
a) 0 = H produktov)
-H(reaktantov) c) produkty
sa menia na reaktanty
b) je u endotermických
reakcií väčšie ako 0 d) druh
a počet atómov sa mení
c) závisí od
látkového množstva
d) Q = 1
[(produktov) -11(reaktantov)
počet elektrónov zapojených do kovalentnej väzby s iným druhom atómov
schopnosť atómov reagovať s kyslíkom
počet atómov kyslíka v zlúčenine
počet atómov, s ktorými sa O môže zlúčiť
Pre chemickú reakciu platí
počet atómov toho istého druhu je na oboch stranách rovnaký
atómy sa môžu meniť na iné atómy
atómy môžu v reakciách vznikať a zanikať
reaktanty píšeme vždy na pravú stranu rovnice
23. Oxidačné čísla atómov zľava doprava v K2H3I06
I, I, VII, -II
II, III, I, IV
I, II, III, IV
i, I, V, -II
24. Pre reakciu FeCI2+K2Cr04-FeCI3+CrCI3+KCI+H2O pliati
je to redoxná reakcia
oxidačné číslo O sa nemení
(r sa oxiduje
ľe sa redukuje
25
Pre reakciu Pb(NO3)2+KI-Pbl2+KN03 platí
je to oxidačno-redukčná reakcia
jód sa oxiduje
Pb sa redukuje
d) oxidačné číslo N sa mení
Pre chemickú reakciu platí
a) čím viacej energie sa uvoľní, tým sú väzby
v produktoch pevnejšie
b) čím sú väzby v reaktantoch pevnejšie,
tým je väčšia aktivačná energia
c)
čím sú väzby v produktoch pevnejšie, tým majú
produkty nižšiu energiu
d)
čim sú väzby v produktoch slabšie, tým majú
produkty vyššiu energiu
27.
Pre chemickú reakciu platí
pri exotermickej reakcii majú reaktanty vyššiu energiu ako produkty
pri endotermickej reakcii majú reaktanty vyššiu energiu ako produkty
pri exotermickej reakcii majú reaktanty silnejšie väzby ako produkty
pri exotermickej reakcii majú produkty silnejšie väzby ako reaktanty
28.
Energia prechodového komplexu
je najvyšší energetický stav v priebehu reakcie
čím je vyššia, tým je prechodový komplex menej stály
časť sa uvoľní pri jeho rozpade
časť sa uvoľní pri jeho vzniku
29. Reakčné teplo Q
vyjadrujeme v kJ.mol-1
je rozdielom entalpií reaktantov a produktov
c)je u exotermických reakcií menšie ako 0
d)
jeho závislosť na látkovom množstve je priamoúmemá
31. Pre reakciu H,0(g) + C(s) - CO(g) + H2(g) aH=131.4kJ.moľ piati
je to exotermická reakcia
väzby v reaktantoch sú silnejšie ako väzby v produktoch
produkty majú vyšší obsah energie
voda je v kvapalnom stave
32. Vvberte exotermické reakcie
4NH, + 5 0,-*4NO + 6H,0 a H= -906kJ.moľ
C + 2S-CS, .H=-128kJ.moľ'
3C + 2Fe,0,-4Fe-4Fe + 3C02 4H = 463,8 kJ.moľ
CH, + 2 O, - CO, + 2 H O «H = -571,6 kJ.mol'
34. Štiepenie väzieb v reaktantoch
je spojené so spotrebou energie
je spojené s uvoľnením energie
nemá vplyv na zmenu energie
k štiepeniu nedochádza
-35. Reakcia 2 S03(g) - 2 S02(g) + 02(g) Q= 195,4 kJ/mol je
exotermická endotermická syntéza analýza
. CO (g) Q = -394 kJ.moľ1
36. Reakcia C(s) + 02(g
je exotermická
endotermická
syntéza
analýza
37. Vyberte správne tvrdenia
entalpia reaktantov pri endotermických reakciách je väčšia ako entalpia produktov
endotermické reakcie prebiehajú len pri sústavnom dodávaní energie
pre exotermickú reakciu platfc H>0
entalpia produktov pri endotermických reakciách
38. Hodnota reakčného tepla priamej reakcie
a spätnej reakcie je rovnaká, líši sa len znamienkom
je u exotennickej reakcie väčšia ako u spätnej reakcie,
líši sa znamienkom
je u exotennickej reakcie menšia ako u spätnej reakcie,
líši sa znamienkom
d)
je u endotennickej reakcie menšia ako u spätnej reakcie,
líši sa znamienkom
39. Reakčné teplo
priamej a spätnej reakcie je rôzne, líši sa aj znamienkom
určitej reakcie sa rovná súčtu reakčných tepiel čiastkových reakcií
je teplo, ktoré sa využíva na ohrev okolia
je teplo, ktoré sa uvoľní pri endotennickej reakcii
40. F.xotennické reakcie:
chemické väzby v produktoch sú silnejšie ako v reaktantoch
sú reakcie pri ktorých sa teplo uvoľňuje
produkty majú nižšiu energiu ako reaktanty
produkty majú vyššiu energiu ako reaktanty
41. Hodnota aktivačnej energie:
je daná rozdielom energie prechodového komplexu a energie reaktantov
určuje hodnotu reakčného tepla reakcie
je určená rovnovážnou konštantou
určuje rýchlosť chemickej reakcie
42. O priebehu chemických reakcií platí:
43. O priebehu chemických reakcií platí:
zanikajú väzby v produktoch
reaktanty sa menia na produkty
vznikajú väzby v reaktantoch
reaktanty sa nemenia
44. Rovnovážny stav reakcie:
a)
je stav, keď sa koncentrácie produktov rovnajú
koncentráciám reaktantov
je stav, pri ktorom reakcia prebieha rovnako rýchlo
v oboch smeroch
charakterizuje rovnovážna konštanta
je stav, keď sa všetky reaktanty premenili na produkty
33. Vvberte endotermické reakcie
4NH, + 502 –> 4NO + 6H20 ▲H=-906kJ.mor'
C + 2S CS, ▲H=-128kJ.mol-'
3C + 2Fe203 –> 4Fe + 3C02 ▲H = 463,8 kJ.moľ'
CH4 + 2 O2 –> CO2 + 2 R,0 ▲H =-571,6 kJ.moľ
45. Zvýšenie tlaku v rovnovážnom stave spôsobí:
zmenšenie koncentrácie v smere menšieho počtu molov plynných látok
zväčšenie koncentrácie v smere menšieho počtu molov plynných látok
zväčšenie koncentrácie v smere väčšieho počtu molov plynných látok
zmenšenie koncentrácie v smere väčšieho počtu molov plynných látok
46. Zníženie teploty v rovnovážnom stave spôsobí:
zmenšenie koncentrácie v smere väčšieho počtu molov plynných látok
zmenšenie koncentrácie v smere menšieho počtu molov plynných látok
zväčšenie koncentrácie v smere väčšieho počtu molov plynných látok
zväčšenie koncentrácie v smere menšieho počtu molov plynných látok
47. Zníženie tlaku v rovnovážnom stave spôsobí:
zmenšenie koncentrácie v smere menšieho počtu molov plynných látok
zväčšenie koncentrácie v smere menšieho počtu molov plynných látok
zmenšenie koncentrácie v smere väčšieho počtu molov plynných látok
zväčšenie koncentrácie v smere väčšieho počtu molov plynných látok
48. Účinnosť zrážok závisí:
od priestorovej orientácie častíc
od kinetickej energie častíc
od koncentrácie produktov
od koncentrácie reaktantov
4l). Inhibítor aktivačnú energiu:
zväčšuje a tým reakciu urýchľuje
zmenšuje a tým reakciu urýchľuje
zväčšuje a tým reakciu spomaľuje
zmenšuje a tým reakciu spomaľuje
50. Katalyzátor aktivačnú energiu:
zväčšuje a tým reakciu spomaľuje
zväčšuje a tým reakciu urýchľuje
zmenšuje a tým reakciu urýchľuje
zmenšuje a tým reakciu spomaľuje
51. Aktivačná energia je rozdiel energii:
aktivovaného komplexu a reaktantov
aktivovaného komplexu a produktov
reaktantov a produktov
reaktantov a aktivovaného komplexu
52. Účinnosť zrážok závisí:
od priestorovej orientácie častíc
od kinetickej energie častíc
od koncentrácie produktov
od koncentrácie reaktantov
53. Reakčné teplo:
a) závisí od látkového množstva reaktantov
b) je rozdiel entalpií produktov a reaktantov
sa vyjadruje v kj na mol
|e rozdiel entalpií reaktantov a produktov
54. (l chemickej rovnováhe platí:
a) koncentrácia reaktantov a produktov je konštantná
b) reakcie po určitom čase už neprebiehajú
reakcie prebiehajú, ale rovnakou rýchlosťou
má dynamický charakter
55. Rovnovážny stav
je stav, keď sa rýchlosť oboch reakcií zastaví
medzi reaktantmi a produktami znázorňujeme šípkou zľava doprava
c) je keď sa ustália rovnovážne koncentrácie
d) je keď sa rýchlosť priamej a spätnej reakcie rovná
56. Hodnota rovnovážnej
konštanty chem. reakcie
a) závisí
od počiatočnej koncentrácie reaktantov
b)
závisí od konečnej koncentrácie reaktantov
závisí od počiatočnej koncentrácie produktov
závisí od konečnej koncentrácie produktov
57. Hodnota rovnovážnej konštanty
závisí od teploty
ak je veľká, rovnováha je posunutá vpravo
ak je veľká, rovnováha je posunutá vľavo
ak je malá, rovnováha je posunutá vpravo
58. Chemickú rovnováhu možno ovplyvniť
zmenou koncentrácie reaktantov
zmenou teploty u endotermických reakcií
zmenou teploty u exotermických reakcií
zmenou tlaku v reakciách pevnvch látok
59. Rovnováha v endotermických reakciách
sa zvýšením teploty posunie doprava
sa zvýšením teploty posunie doľava
sa zvýšením teploty nezmení
rovnovážna konštanta sa zvýšením teploty zväčší
60. Rovnováha v exotermických reakciách
rovnovážna konštanta sa zvýšením teploty zväčši
sa zvýšením teploty posunie doprava
rovnovážna konštanta sa zvýšením teploty zmenší
zvýšená teplota na rovnováhu nepôsobí
61. Rovnováha v chemických reakciách
sa zväčšením koncentrácie reaktantov posunie doprava
sa zväčšením koncentrácie produktov posunie doprava
c) sa zmenšením koncentrácie reaktantov
posunie doprava
d)
sa zväčšením koncentrácie
reaktantov
nezmení
62. Plynný jód a vodík reagujú za vzniku plynného Hl. Y rovnovážnom stave závisí hodnota K od
začiatočnej koncentrácie jódu
teploty
začiatočného tlaku vodíka
objemu reakčného systému
63. V uzavretej nádobe sa ustálila rovnováha MgCO3(s) –> MgO(s) + CO2(g) AH>0 Zvýšenie výťažku MgO možno dosiahnuť
zväčšením objemu nádoby
pridaním uhličitanu horečnatého
zmenšením teploty
dl odstraňovaním oxidu uhličitého z nádoby
64. Na základe uvedenej termochemickej rovnice platí
2 CO(g) + 0,(g) ~ 2 CO,(g) AH = -566kJ.moľ
reakcia v smere vzniku CO je endotermická
zvýšenie teploty posunie rovnováhu doprava
zmena tlaku neovplyvní rovnováhu
rovnováha sa nedá ničím ovplyvniť
WYMAGANE PARAMETRY TECHNICZNE PEŁNA NAZWA ULTRASONOGRAFU PODAĆ PRODUCENT PODAĆ
WYMAGANE PARAMETRY TECHNICZNE ULTRASONOGRAF PEŁNA NAZWA ULTRASONOGRAFU PODAĆ PRODUCENT
Z GRAFU VYPLÝVA 1 CHEMICKÁ KINETIKA A SA ZAOBERÁ
Tags: chemická kinetika, 3. chemická, chemická, vyplýva, kinetika, zaoberá, grafu
- FACULTE DE L’ENVIRONNEMENT NATUREL ARCHITECTURAL ET CONSTRUIT SECTION SCIENCES
- R ECURSOS HUMANOS INCOMPATIBILIDADES PUBLICAS EJERCICIO DE OPCION
- “la Conferencia Internacional Sobre la Población y el Desarrollo
- SOLICITUD DE INGRESO A LA ESPECIALIDAD MODALIDAD ………………………… ESPECIALIDAD
- MISELNI VZROKI ZA NASTANEK BOLEZNI STE VEDELI DA SO
- NÉPESSÉG A SZLOVÁKIAI LAKOSSÁG JELENLEGI LÉTSZÁMÁT ÖSSZETÉTELÉT ÉS FÖLDRAJZI
- LLICÈNCIES TINENÇACONDUCCIÓ GOSSOS PERILLOSOS I AUTOLIQUIDACIÓ DE TAXA (ORDENANÇA
- A VER INSTRUCCIONES CUERDO POR EL QUE SE RECHAZAN
- ZAŁĄCZNIK NR 1 DO REGULAMINU OBEJMOWANIA WYDARZEŃ PATRONATEM BURMISTRZA
- DOTAZNÍK – NÁKUPNÍ ZVYKLOSTI A NÁKUPNÍ SPÁD (OTÁZKY FORMOVÁNÍ
- IDENTIFIKACE DOKUMENTU KSCOVIDRESPIRATORYROUSKYHCWS DATUM VYDÁNÍ 100620 POZNÁMKA DOPORUČENÍ MŮŽE
- RECORDING OF CONFIDENTIAL DETAILS ON MIDATABANK AND ANONYMISING RECORDS
- HTTPWWW LITBANGDEPKES GOID KOMISI ETIK PENELITIAN KESEHATAN BADAN PENELITIAN
- MAXGO084102020 MAXIGRA GO NA EREKCJĘ 8 TABLETEK
- SENATE CONCURRENT RESOLUTION WHEREAS THE SOUTHERN REGION OF DALLAS
- 5 SZÁNTÓD KÖZSÉG ÖNKORMÁNYZATA KÉPVISELŐTESTÜLETÉNEK 222011(XII20) ÖNKORMÁNYZATI RENDELETE A
- REGULAMIN PRZETARGU USTNEGO (AUKCJI) NA SPRZEDAŻ SAMOCHODU OSOBOWEGO DAEWOO
- NA PODLAGI 109 ČLENA ZAKONA O LOKALNIH VOLITVAH (URADNI
- PRIRUČNIK ZA IMPLEMENTACIJU UREDBE MF BR – 042017
- BRIEFING FOR AN EXTERNAL EXAMINER WHERE THE EXTERNAL EXAMINER
- FAKULTÄT FÜR NATURWISSENSCHAFTEN INSTITUT FÜR EXPERIMENTELLE PHYSIK PROF DR
- TRAINING PHONOLOGICAL AWARENESS IN CHILDREN WITH COCHLEAR IMPLANTS SUPERVISOR
- NEDERLAG FÖR SVENSKA REGERINGEN OCH GENGRÖDOR EU SÄGER NEJ
- HERRITARREN SEGURTASUNAREN SAILA DEPARTAMENTO DE SEGURIDAD CIUDADANA WWWVITORIAGASTEIZORG NOTA
- FORMATO DE DECLARACIÓN JURADA DE SILENCIO ADMINISTRATIVO POSITIVO
- POWERPLUSWATERMARKOBJECT19260337 CONTRACT DE FURNIZARE NR 1ÎN TEMEIUL LEGII NR
- 20 GONZÁLEZ REINADO DE DIOS E IMPERIO ANTONIO
- 7 SOUND FUNCTORS APPLICATIONS JÔNATAS MANZOLLI2 ADOLFO MAIA JR12
- MICHAEL KRAFT 10 10 2012 FRIEDRICHEBERTWEG 4 39164 STADT
- DICKERSON ET ALMTL IN AGING & AD PAGE 27
CONCURSO DE FOTOGRAFÍA EN LAS BASES DEL CONCURSO
NA OSNOVU ČLANA 23 USTAVA BOSANSKO – PODRINJSKOG KANTONA
 CAPITULO CATORCE CUIDADO Y MANTENIMIENTO DE MOTORES Y MAQUINARIA
CAPITULO CATORCE CUIDADO Y MANTENIMIENTO DE MOTORES Y MAQUINARIABP Nº 11 IDENTIFICACIÓN DE LA BUENA PRÁCTICA
22 KONTRAKT OM REVISIONSBISTAND I FORBINDELSE MED TILSKUD FRA
WARSZAWA DNIA 25 LIPCA 2011 ROKU DO SĄDU OKRĘGOWEGO
ACTUALIZACIÓN DE MOODLE 15X MOODLE ESTÁ DISEÑADO PARA
 DIRECCIÓN GENERAL DE SERVICIOS SOCIALES INFANCIA Y FAMILIAS ANEXO
DIRECCIÓN GENERAL DE SERVICIOS SOCIALES INFANCIA Y FAMILIAS ANEXOINCIDENCE OF PERTUSSIS (WHOOPING COUGH) GROWING IN GREATER MINNESOTA
DETECT A PROGRAM THAT LOCATES ERRORS IN DNA SEQUENCES
ACTA DE REPLANTEO PREVIO PROGRAMA DE INVERSIÓN PLAN DE
SPISAK UČESNIKA IZ MAĐARSKE NA POSLOVNOM SUSRETU SRPSKO –
 RADIOLOGY LTD DEPENDE DE UNA RED CISCO DE EXTREMO
RADIOLOGY LTD DEPENDE DE UNA RED CISCO DE EXTREMO GOBIERNO DEL PRINCIPADO DE ASTURIAS C ONSEJERÍA DE MEDIO
GOBIERNO DEL PRINCIPADO DE ASTURIAS C ONSEJERÍA DE MEDIO MEMÒRIA PARTICIPACIÓ CIUTADANA 2003 – 2007 INDEX 1 EL
MEMÒRIA PARTICIPACIÓ CIUTADANA 2003 – 2007 INDEX 1 ELWOJEWÓDZKIE BIEGANIE W TYCHOWIE W DNIU 22 PAŹDZIERNIKA
 1 A 07 AFRICAN AMERICAN AFFAIRS (UPDATED AUGUST 2021)
1 A 07 AFRICAN AMERICAN AFFAIRS (UPDATED AUGUST 2021)880 INVOICE – SAMPLE DATA ISA00 00 089254110MFG 08RESOURCE1
FULL TITLE TOWARDS A FUTURE OF EQUITABLE PEDAGOGY AND
ZAŁĄCZNIK NR 2 DO WKO NR SPRAWY KO 6MED2019