TRAVOPROST HIPERTENSIÓN OCULAR Y GLAUCOMA DE ÁNGULO ABIERTO (INFORME
TRAVOPROST HIPERTENSIÓN OCULAR Y GLAUCOMA DE ÁNGULO ABIERTO (INFORME
Informe base modelo simplificado
|
TRAVOPROST Hipertensión ocular y glaucoma de ángulo abierto (Informe para la Comisión de Farmacia y Terapéutica del Hospital Virgen Arrixaca)Fecha 06/04/2006
|
|
1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME |
Fármaco: Travoprost
Indicación clínica solicitada: hipertensión ocular o glaucoma de ángulo abierto.
Autores / Revisores: Alberto Espuny, Paqui Cortés y Amelia de la Rubia.
Declaración Conflicto de Intereses de los autores: no.
|
2.- SOLICITUD Y DATOS DEL PROCESO DE EVALUACIÓN: |
Facultativo que efectuó la solicitud: Dr. Fernández.
Servicio: Oftalmología.
|
3.- AREA DESCRIPTIVA DEL MEDICAMENTO. |
Nombre genérico: Travoprost.
Nombre comercial: Travatan colirio 0,004%.
Laboratorio: Alcón Cusi.
Grupo terapéutico. Denominación: Otros preparados antiglaucoma. Código ATC: S01EE04.
Vía de administración: Oftálmica.
Tipo de dispensación: Con receta médica.
Vía de registro: Procedimiento centralizado.
|
Presentaciones y precio |
||||
|
Forma farmacéutica y dosis |
Envase de x unidades |
Código |
Coste por unidad PVP con IVA (opcional) |
Coste por unidad PVL con IVA |
|
Travatan colirio 0,004% 2,5mL |
1 |
959817 |
20,64€ |
13,33 € |
|
4.- AREA DE ACCIÓN FARMACOLÓGICA. |
4.1 Mecanismo de acción.
Es un análogo de la prostaglandina F2α, es un agonista completo muy selectivo. Posee una alta afinidad por el receptor PF de prostaglandinas y reduce la presión intraocular aumentando el drenaje del humor acuoso. Al igual que otros análogos de prostaglandinas, no se conoce exactamente el mecanismo de acción por el cual Travoprost reduce la presión intraocular; aunque, se cree que aumenta el flujo de salida uveoscleral.
4.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación.
AEM: Reducción de la presión intraocular elevada en pacientes con hipertensión ocular o glaucoma de ángulo abierto que no toleren o no responden adecuadamente a otros tratamientos para la reducción de la presión intraocular, bien como monoterapia o terapia coadyuvante. Noviembre 2001.
EMEA: Reducción de la presión intraocular elevada en pacientes con hipertensión ocular o glaucoma de ángulo abierto. Noviembre 2001.
FDA: TRAVATANTM Ophthalmic Solution is indicated for the reduction of elevated intraocular pressure in patients with open-angle glaucoma or ocular hypertension who are intolerant of other intraocular pressure lowering medications or insufficiently responsive (failed to achieve target IOP determined after multiple measurements over time) to another intraocular pressure lowering medication. Marzo 2001.
4.3 Posología, forma de preparación y administración.
Adultos incluidos ancianos: La dosis es de una gota una vez al día en el saco conjuntival de ojo/s afectado/s. El efecto es óptimo si se administra por la noche.
Sí se administra conjuntamente con otro fármaco las administraciones deben espaciarse al menos 5 minutos.
4.4 Farmacocinética.
Travoprost es un profármaco en forma de éster. Se absorbe a través de la córnea donde se hidroliza a ácido libre activo. La reducción de la presión intraocular en humanos se inicia aproximadamente 2 horas tras la administración y el efecto máximo se alcanza sobre las 12 horas. La reducción de presión se mantiene al menos durante 24h.
Estudios en conejos han mostrado que se alcanzan concentraciones máximas en humor acuoso de 20ng/g entre 1 y 2 horas tras la administración.
La vía de eliminación es por metabolismo y aprovecha las vías metabólicas sistémicas de la prostaglandina endógena F2α, que consiste en: reducción del doble enlace 13-14, oxidación del 15-hidroxilo lisis β-oxidativa de la parte superior de la cadena.
Tras su administración en humanos sanos se han podido detectar durante la primera hora concentraciones plasmáticas de ácido libre (hasta 25 pg/mL) pero enseguida caen por debajo del límite de detección de la técnica y no se han podido establecer parámetros farmacocinéticos.
4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital.
|
Características comparadas con otros medicamentos similares |
|||
|
Nombre |
XALATAN |
XXXXX |
XXXXX |
|
Presentación
|
Colirio 0,005% |
|
|
|
Posología
|
1 gota c/24h |
|
|
|
Características diferenciales
|
Prácticamente ninguna |
|
|
|
5.- EVALUACIÓN DE LA EFICACIA. |
5.1 Ensayos clínicos disponibles para la indicación clínica evaluada.
La eficacia y seguridad de Travoprost se ha estudiado en los cuatro ensayos pivotales: tres en monoterapia y uno en asociación a timolol cuyas referencias son las siguientes:
Estudio C-97-71: US. NETLAND et al. (Travoprost study group).Travoprost compared with latanoprost and timolol in patients with open-angle glaucoma or ocular hypertension. Ophthalmology 2001; 132: 472-484.
Estudio C-97-72: US. FELLMAN et al. (Travoprost study group). Comparison of travoprost 0,0015% and 0,004% with timolol 0,5% in patients with elevated intraocular pressure. Ophthalmology 2002; 109: 998-1008.
Estudio C-97-73: US. ORENGO-NANIA et al. Evaluation of travoprost as adjunctive therapy in patients with uncontrolled intraocular pressure while using timolol 0,5%. American Journal of Ophthalmology 2001; 132: 860-868.
Estudio C-97-79: EU/Australia. FRANZCO et al. (International travoprost study group). Comparison of topical travoprost eye drops given once daily and timolol 0,5% given twice daily in patients with open-angle glaucoma or ocular hypertension. Journal of Glaucoma 2001; 10: 414-422.
Todos a doble ciego y randomizados en pacientes con glaucoma de ángulo abierto o hipertensión ocular y que se describen a continuación. Aunque no se especifica en cada estudio, como en todos hay timolol que se administra c/12h, los pacientes que entraban en los grupos de una dosis diaria (travoprost o latanoprost) se les administraba además una dosis de placebo para enmascarar.
En los cuatro ensayos la medida de la presión intraocular se realizó de la misma manera: 8h, 10h y 16h en las visitas realizadas a la semana 2, mes 3, mes 6 y mes 12; y a las 8h y 10h en las visitas realizadas al mes 1,5, mes 4,5 y mes 9 (cortando cada ensayo en su punto correspondiente según la duración).
5.2 Resultados de los ensayos clínicos.
Estudio C-97-71: US. NETLAND et al. (Travoprost study group).Travoprost compared with latanoprost and timolol in patients with open-angle glaucoma or ocular hypertension. Ophthalmology 2001; 132: 472-484.
Ensayo multicéntrico para estudiar la eficacia y seguridad de Travoprost a concentración 0,0015% y 0,004% comparándolos frente a timolol 0,5% y Latanoprost 0,005%.
205 pacientes recibieron travoprost 0,0015% una vez al día, 200 pacientes travoprost 0,004% una vez al día, 200 latanoprost 0,005% una vez al día y 196 timolol 0,5% dos veces al día durante 12 meses. La variable medida era la presión intraocular.
La respuesta se consideraba clínicamente relevante si la presión intraocular era igual o inferior a 17 mmHg o el descenso era de un 30% o superior.
Los porcentajes de respuesta fueron travoprost 0,004% 54,7%, travoprost 0,0015% 49,3%, latanoprost 0,005% 49,6% y timolol 0,5% 39,0%. Las diferencias entre las dos dosis de travoprost ensayadas, latanoprost y timolol no son significativas.
Estudio C-97-72: US. FELLMAN et al. (Travoprost study group). Comparison of travoprost 0,0015% and 0,004% with timolol 0,5% in patients with elevated intraocular pressure. Ophthalmology 2002; 109: 998-1008.
Ensayo multicéntrico para estudiar la eficacia y seguridad de Travoprost a concentración 0,0015% y 0,004% comparándolos frente a timolol 0,5%.
202 pacientes recibieron travoprost 0,0015% una vez al día, 201 pacientes travoprost 0,004% una vez al día y 202 timolol 0,5% dos veces al día durante 6 meses. La variable medida era la presión intraocular.
La respuesta se consideraba clínicamente relevante si la presión intraocular era igual o inferior a 17 mmHg o el descenso era de un 30% o superior.
Los porcentajes de respuesta fueron travoprost 0,004% 50,5%, travoprost 0,0015% 45,1% y timolol 0,5% 35,4%. Las diferencias entre las dos dosis de travoprost ensayadas y timolol no son significativas.
Estudio C-97-73: US. ORENGO-NANIA et al. Evaluation of travoprost as adjunctive therapy in patients with uncontrolled intraocular pressure while using timolol 0,5%. American Journal of Ophthalmology 2001; 132: 860-868.
Ensayo multicéntrico para estudiar la eficacia y seguridad de Travoprost a las concentraciones 0,0015% y 0,004% c/24h + timolol 0,5% c/12h comparándolos frente a timolol 0,5% c/12h + placebo c/24h en pacientes que no estaban bien controlados con timolol. La duración del ensayo fue de 6 meses y la variable medida la presión intraocular.
En el primer grupo entraron 142 pacientes, en el segundo 146 y en el tercero 139.
La respuesta se consideraba clínicamente relevante si la presión intraocular era igual o inferior a 20 mmHg o el descenso era de 6 mmHg o superior.
Los porcentajes de respuesta fueron:
Travoprost 0,0015 % + timolol 0,5 % - 82,7 %*
Travoprost 0,004 % + timolol 0,5 % - - 86,9 %*
Timolol 0,5 % + placebo -------------- 43,3%
*Respuesta estadísticamente significativa.
Estudio C-97-79: EU/Australia. FRANZCO et al. (International travoprost study group). Comparison of topical travoprost eye drops given once daily and timolol 0,5% given twice daily in patients with open-angle glaucoma or ocular hypertension. Journal of Glaucoma 2001; 10: 414-422.
Ensayo multicéntrico para estudiar la eficacia y seguridad de Travoprost a concentración 0,0015% y 0,004% comparándolos frente a timolol 0,5%.
190 pacientes recibieron travoprost 0,0015% una vez al día, 197 pacientes travoprost 0,004% una vez al día y 186 timolol 0,5% dos veces al día durante 9 meses. La variable medida era la presión intraocular.
La respuesta se consideraba clínicamente relevante si la presión intraocular era igual o inferior a 17 mmHg o el descenso era de un 30% o superior.
Los porcentajes de respuesta fueron travoprost 0,004% 63,3%, travoprost 0,0015% 54,8% y timolol 0,5% 47,1%. Las diferencias entre las dos dosis de travoprost ensayadas y timolol no son significativas.
Las principales características de los cuatro ensayos las resumimos en las siguientes tablas:
|
Ensayo |
Duración |
Nº pacientes |
Grupos |
% Respuesta* |
|
C-97-71 |
12 meses |
801 (1:1:1:1) |
Travoprost 0,0015% Travoprost 0,004% Latanoprost 0,005% Timolol 0,5% |
49,3% 54,7% 49,6% 39,0% |
|
C-97-72 |
6 meses |
605 (1:1:1) |
Travoprost 0,0015% Travoprost 0,004% Timolol 0,5% |
45,1% 50,5% 35,4% |
|
C-97-79 |
9 meses |
573 (1:1:1) |
Travoprost 0,0015% Travoprost 0,004% Timolol 0,5% |
54,8% 63,3% 47,1% |
* Se entiende como respuesta clínica la presión intraocular ≤ 17 mmHg o descenso de un 30% o superior (las diferencias en los porcentajes no son significativas).
|
Ensayo |
Duración |
Nº pacientes |
Grupos |
% Respuesta* |
|
C-97-73 |
6 meses |
427 (1:1:1) |
timolol 0,5%+Travoprost 0,0015% timolol 0,5%+Travoprost 0,004% timolol 0,5%+Placebo |
82,7%** 86,9%** 43,3% |
* Se entiende como respuesta clínica la presión intraocular ≤ 20 mmHg o un descenso en 6 mmHg o superior.
** Respuesta estadísticamente significativa.
|
6. EVALUACIÓN DE LA SEGURIDAD. |
6.1 Descripción de los efectos secundarios más significativos (por su frecuencia o gravedad)
Las principales reacciones adversas descritas son locales (oculares) y algunas sistémicas que resumimos a continuación (Micromedex):
|
Tipo |
Reacción |
Porcentaje |
|
Local (hasta un 50%) |
Hiperemia ocular |
35-50% |
|
|
Prurito ocular |
5-10% |
|
|
Molestias oculares |
5-10% |
|
|
Visión borrosa |
5-10% |
|
|
Sensación de cuerpo extraño |
5-10% |
|
|
Cambio en pigmentación iris |
3-5% |
|
|
Cataratas |
1-2% |
|
|
Uveítis y edema corneal |
Raro |
|
|
|
|
|
Sistémica (4%) |
Cefalea |
1-2% |
|
|
Hipotensión y bradicardia |
1-2% |
|
|
Asma |
<1% |
Con diferencia la principal reacción adversa es la hiperemia ocular, pero en el 92,4% de los pacientes fue leve.
En general los efectos adversos son leves y no conllevan la retirada del tratamiento. Como ejemplo, sirvan los datos del estudio C-97-71 en el que abandonaron el tratamiento a causa de los efectos secundarios (incluye los relacionados y no relacionados con el fármaco estudiado) los siguientes porcentajes de pacientes: 4,7% de los pacientes en tratamiento con travoprost 0,015%, 5,8% con travoprost 0,004%, 3,1% con latanoprost 0,005% y 3,9% con timolol 0,5%.
6.2 Precauciones de empleo en casos especiales,
Niños y adolescentes: No se ha establecido la seguridad y eficacia en pacientes menores de 18 años y por ello no se aconseja su uso.
Insuficiencia hepática y renal: Se ha estudiado su uso en ambas y tanto en leve como grave. No es necesario un ajuste de dosis en estos pacientes.
Embarazo y edad fértil: Estudios en animales han mostrado toxicidad sobre la reproducción. El riesgo potencial en humanos es desconocido. En consecuencia, no debe usarse durante el embarazo y deben utilizarse medidas anticonceptivas adecuadas en las mujeres en edad fértil.
Lactancia: Estudios en animales indican que Travoprost y sus metabolitos pasan a leche por lo que tampoco se recomienda su uso.
Contraindicaciones: Hipersensibilidad a travoprost o alguno de sus componentes.
|
7. AREA ECONÓMICA |
Coste unidad travatan® colirio 2,5 mL 13,33€.
Coste unidad xalatan® colirio 2,5 mL 14,46€.
Coste unidad timoftol® colirio 3 mL 1,80€.
|
8.- AREA DE CONCLUSIONES. |
8.1 Resumen de los aspectos más significativos.
- Travoprost, al igual que latanoprost, es un análogo de la prostaglandina F2α. Posee una alta afinidad por el receptor PF de prostaglandinas y reduce la presión intraocular aumentando el drenaje del humor acuoso.
- La eficacia y seguridad de travoprost ha sido estudiada en varios ensayos clínicos. En dichos ensayos travoprost ha demostrado una pequeña superioridad (no significativa) frente a timolol pero prácticamente la misma que latanoprost (C-97-71). Tampoco hay diferencias importantes en cuanto a efectos adversos.
- La asociación de timolol + travoprost (análogo de la prostaglandina F2α) sí ha demostrado ser superior a timolol + placebo.
- En la práctica no hay diferencias económicas entre los dos análogos de prostaglandina F2α estudiados.
- Latanoprost es un fármaco incluido en la guía del hospital.
|
9.- BIBLIOGRAFÍA. |
- Micromedex ® 2006.
- FDA label. (www.fda.gov).
- EMEA: scientific discussion – 2003. (www.emea.eu.int).
- Ensayos clínicos pivotales. (www.uiowa.edu).
- Ficha técnica de travatan®. Ministerio de Sanidad y Consumo (http://sinaem.agemed.es:83/presentacion/principal.asp).
- Product information: travatan®. Alcón Laboratoires, Inc., Fort Worth, 2003.
NETLAND et al. (Travoprost study group).Travoprost compared with latanoprost and timolol in patients with open-angle glaucoma or ocular hypertension. Ophthalmology 2001; 132: 472-484.
FELLMAN et al. (Travoprost study group). Comparison of travoprost 0,0015% and 0,004% with timolol 0,5% in patients with elevated intraocular pressure. Ophthalmology 2002; 109: 998-1008.
ORENGO-NANIA et al. Evaluation of travoprost as adjunctive therapy in patients with uncontrolled intraocular pressure while using timolol 0,5%. American Journal of Ophthalmology 2001; 132: 860-868.
FRANZCO et al. (International travoprost study group). Comparison of topical travoprost eye drops given once daily and timolol 0,5% given twice daily in patients with open-angle glaucoma or ocular hypertension. Journal of Glaucoma 2001; 10: 414-422.
|
EVALUACIÓN: Conclusiones finales
|
|
Fecha de evaluación por la CFyT: 06/04/06 Fecha de notificación: 07/04/06
“Decisión adoptada por la CFyT”: La comisión acordó no incluir travoprost al haber ya un análogo de prostaglandina F2α incluido en el hospital. Considera que es de eficacia y seguridad comparable a la alternativa existente clasificándolo en la categoría C-1.
|
Tags: (informe para, travoprost, ángulo, hipertensión, ocular, abierto, glaucoma, (informe
- H RVATSKI RONILAČKI SAVEZ CROATIAN DIVING FEDERATION DALMATINSKA 12
- MARCO LEGAL DE LOS DERECHOS DEL PRODUCTOR DE FONOGRAMAS
- INFRACCIONES Y SANCIONES TRIBUTARIAS DE LA ADMINISTRACIÓN DE LA
- LIVING WITH BABIES HAVING A BABY CAN BE
- 19 UNIVERSITÄTSMEDIZIN BERLIN LOGBUCH PRAKTISCHES JAHR PHONIATRIE & PÄDAUDIOLOGIE
- 6 FORDULÓ CSAPATNÉV RAKD SORBA! RAKD SORBA AZ ÓSZÖVETSÉG
- ISTEN INGYEN ENERGIÁJA IIRÉSZ 1 PAUL M BROWN
- LIGA Z2 4KOLO OŠ KOPRIVNIČKI BREGI – ŽKK KOPRIVNICA
- KNOWLEDGE MANAGEMENT AND HISTORY JEANLOUIS ERMINE BERTRAND PAUGET
- FORM LAA 1081 DETERMINATION INCREASING PERIOD OF CURRENCY OF
- 2013亞太創業競賽創業新秀組 公司基本資料 INTRODUCTION ESTABLISHED:20100111 公司名稱 COMPANY NAME 英文 TECHGIANTART
- DOCUMENTO FORMATO CODIGO DMGDANTA201603 FORMATO DE TIPOLOGIA DE DOCUMENTOS
- INDICADORES DE COHESIÓN GRUPAL A CONSIDERAR PARA SU DIAGNÓSTICO
- M OLECULAR DESIGN AND THERAPEUTICS LAB PROTEIN WORK ORDER
- KÓSA GÉZA MESTERHÁZY ZSOLT CONIFER TREASURY 70 OF
- HVA VIL UNGDOMMEN – OG HVORDAN FÅR VI ENGASJERT
- ANA TIJOUX HACE LLAMADO DE ATENCIÓN POR PRESOS MAPUCHE
- (NACRT PREDLOGA) NA OSNOVU ČLANA 191 STAV 1 USTAVA
- S ERVICIO GEOGRÁFICO MILITAR LA CARTOGRAFÍA OFICIAL DEL URUGUAY
- JOHN BURIDAN AND THE FORCECONTENT DISTINCTION INTRODUCTION THE
- ASAMBLEA LEGISLATIVA INFORME ANUAL DE EVALUACIÓN PRESUPUESTARIA 2006 MEDIANTE
- GUIDANCE TO BROADCASTERS ON THE REGULATION OF INTERACTIVE TELEVISION
- Security Settings and adi Journal Quick Reference Guide Contents
- GERNIKALUMOKO KULTUR EGITARAUA IRAILA 2017 – ZAPATUA 2
- ANHANG P4 EIGENSCHAFTEN DES BEWERBERS ODER DES ANBIETERS
- LĪGUMS NR PAR DALĪBU EIROPAS UN LATGALES
- COACYLE CAT 05020309 CENTRO ASESORAMIENTO TECNOLÓGICO DEL COACYLE
- REACTIVOS TIPO ENLACE ACADEMIA CIENCIAS NATURALES Y EXPERIMENTALES 2013
- 2 GOBIERNO DE PUERTO RICO 18VA ASAMBLEA 7MA SESIÓN
- [VERSION 81 012017] PRILOGA I POVZETEK GLAVNIH ZNAČILNOSTI ZDRAVILA
NAZIV OBVEZNIKA NARODNA KNJIŽNICA BROJ RKPA 26282 POŠTANSKI BROJ
NORMAS PRÁCTICAS PARA USO INTERNO DE LAS EMPRESAS ANTE
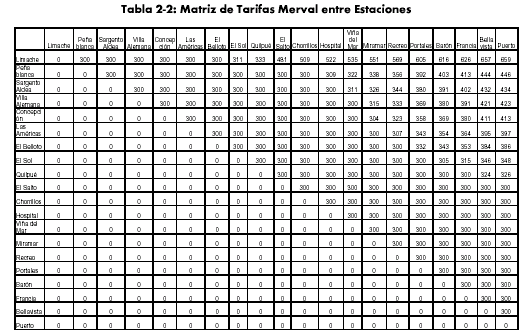 DESCRIPCIÓN GENERAL DEL PLAN DE LICITACIÓN DE VÍAS GRAN
DESCRIPCIÓN GENERAL DEL PLAN DE LICITACIÓN DE VÍAS GRANI CERTAMEN IBEROAMERICANO DE DIBUJO FUNDACIÓN PATRONATO DE HUÉRFANOS
ÍNDICE TEMÁTICO RÉGIMEN CONSTITUTIVO Y LEGAL (SUSTITUIR POR EL
MULIGHETER FOR VERBAL KOMMUNIKASJON DEFLATERT CUFF TRACHEOSTOMIKANYLE
Gdynia Dnia r Nazwisko i Imię Rodzaj Studiów
PRACTICAL 1 DIGITAL IMAGE DISPLAY AND ENHANCEMENT DIGITAL IMAGE
 Ayuntamiento de Juviles Asistentes Alcaldesa dª mª Lourdes Molina
Ayuntamiento de Juviles Asistentes Alcaldesa dª mª Lourdes Molina WHAT TO DO IF YOU SEE OR HEAR SOMETHING
WHAT TO DO IF YOU SEE OR HEAR SOMETHINGPříloha č 1 uhk Licenční Smlouvy Předávací Protokol
YOUTH ASSOCIATION FOR CHANGE TEL +255788076474 FAX NIL EMAIL
 SARAYBOSNA ÜNİVERSİTESİ İÇİN GEREKLİ EVRAKLAR LİSE DİPLOMASI LISE DIPLOMASI
SARAYBOSNA ÜNİVERSİTESİ İÇİN GEREKLİ EVRAKLAR LİSE DİPLOMASI LISE DIPLOMASI ADVERTENCIA ESTÁS A PUNTO DE LEER UN TEXTO MUY
ADVERTENCIA ESTÁS A PUNTO DE LEER UN TEXTO MUYWIEF PRESS CONFERENCE STATEMENT BY THE MINISTER OF STATE
 MÓDSZERTANI HÍRLEVÉL DÉLDUNÁNTÚLI RÉGIÓ 2001 JÚNIUS TARTALOM MÓDSZERTANI
MÓDSZERTANI HÍRLEVÉL DÉLDUNÁNTÚLI RÉGIÓ 2001 JÚNIUS TARTALOM MÓDSZERTANI CIRCOLO DI STUDI DIPLOMATICI DIALOGHI DIPLOMATICI 242 “EUROPA
CIRCOLO DI STUDI DIPLOMATICI DIALOGHI DIPLOMATICI 242 “EUROPACHAPTER 4 PASSION LOVE AND SEXUAL BEHAVIOR OVERVIEW
 LOS ADJETIVOS POSESIVOS POSSESSIVE ADJECTIVES ARE USED TO SHOW
LOS ADJETIVOS POSESIVOS POSSESSIVE ADJECTIVES ARE USED TO SHOWRENCANA PEMBELAJARAN SEMESTER MATA KULIAH DESAIN MEDIA SEMESTER