ZAD DLA UCZNIÓW KLAS 1 2 NA SPRAWDZIAN Z
Rejestr Wypadków Uczniów ( Dzieci ) lp Imię i
ZAD DLA UCZNIÓW KLAS 1- 2 NA SPRAWDZIAN Z DZIAŁU BUDOWA ATOMU
Konsultacje we wtorki na LEKCJI siódmej w SALI 46
Przykładowe zadania – budowa atomu, izotopy. Zad podstawowe na oceny 3,4,5
Podaj liczbę elektronów walencyjnych w następujących atomach: 4Be, 7N, 11Na, 15P.
Podaj symbole i liczby powłok elektronowych atomów pierwiastków o następujących liczbach atomowych: 9, 12, 14, 17.
Podaj symbole i nazwy pierwiastków o liczbach atomowych równych:
Sumie liczby elektronów walencyjnych atomu chloru i liczby elektronów niewalencyjnych atomu magnezu,
Ilorazowi liczby elektronów walencyjnych atomu fosforu przez liczbę powłok elektronowych atomu jodu,
Iloczynowi liczby elektronów atomu fluoru i liczby elektronów walencyjnych atomu wapnia.
Podaj:
Liczbę protonów,
Liczbę wszystkich elektronów,
Liczbę elektronów walencyjnych,
Liczbę powłok elektronowych,
Dla następujących atomów:
11Na, 13Al, 14Si
12Mg, 16S, 18Ar,
5B, 9F, 19K,
3Li, 7N, 17Cl.
Atom wodoru zawiera jeden proton w jądrze, ale może tworzyć trzy izotopy o liczbach masowych:
1, 2 i 3. Uzupełnij tabelkę opisującą te izotopy:
|
|
Symbol chemiczny izotopu |
|
|
|||
|
|
pełny |
uproszczony |
|
|
||
|
Wodór-1 prot |
|
|
|
|
||
|
Wodór-2 deuter |
|
|
|
|
||
|
Wodór-3 tryt |
|
|
|
|
||
Krzem występuje w przyrodzie w postaci 3 izotopów. Uzupełnij tabelę opisującą te izotopy.
|
|
Symbol chemiczny izotopu |
|
||
|
|
pełny |
uproszczony |
|
|
|
|
1428Si |
|
|
|
|
Krzem-29 |
|
|
|
|
|
|
|
|
16 |
|
Uzupełnij tabelę opisującą izotopy:
|
Symbol izotopu |
612C |
613C |
1224Mg |
1225Mg |
1226Mg |
|
Liczba atomowa |
|
|
|
|
|
|
Liczba masowa |
|
|
|
|
|
|
Liczba protonów |
|
|
|
|
|
|
Liczba neutronów |
|
|
|
|
|
|
Liczba nukleonów |
|
|
|
|
|
Korzystając z układu okresowego uzupełnij tabelkę:
|
Nazwa i symbol pierwiastka |
Numer porządkowy w układzie |
Numer grupy |
Numer okresu |
Liczba elektronów |
Liczba protonów |
Liczba powłok elektronowych |
Liczba elektronów walencyjnych |
|
Azot – N |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
13 |
|
|
|
|
|
|
Korzystając z układu okresowego uzupełnij tabelkę:
|
Nazwa i symbol pierwiastka |
Numer porządkowy w układzie |
Numer grupy |
Numer okresu |
Liczba elektronów |
Liczba protonów |
Liczba powłok elektronowych |
Liczba elektronów walencyjnych |
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
3 |
4 |
|
|
|
|
|
|
10 |
|
|
|
|
17 |
|
|
|
|
|
|
10.W laboratorium w czasie 34 h przechowywano izotop Sr-81 o okresie półtrwania τ˝ = 8,5 h. Początkowa ilość izotopu wynosiła 10 mg. Ile izotopu pozostało po upływie czasu przechowywania?
ZADANIA związane z budową i przemianami jądra atomowego na szóstkę
1) Odkrycia neutronu dokonano w wyniku napromieniowania tarczy z Be – 9 cząstkami α. Napisać2) równania reakcji jądrowych. Podać3) symbol powstałego jądra.
4) Jak zmieni się masa i ładunek jądra izotopu:
W wyniku emisji jednaj cząstki α i dwóch cząstek β
W wyniku absorpcji dwóch protonów i emisji dwóch neutronów
W wyniku absorpcji jednaj cząstki α i dwóch neutronów
Oznaczając Jądro wyjściowe X, a końcowe przez Y, napisać pełne równanie reakcji jądrowych dla powyższych przemian.
5) Izotop potasu K-40 ulega rozpadowi β W jaki pierwiastek przekształci się potas w wyniku tej przemiany. Napisz odpowiednie równanie reakcji.
6) Jaki
był typ rozpadu w następujących przemianach jąder
promieniotwórczych. Napisz odpowiednie równania reakcji
jądrowych:
![]()
7) Napisać8) pełne i uproszczone równania przemiany promieniotwórczej Th-226 w Po-216
9) Ile cząstek α i β powinno utracić10) jądro Bi-209 aby przekształcić11) się w jądro o masie 201 (pierwiastka grupy III). Napisać12) odpowiednie równanie reakcji jądrowej.
13) Jak zmieniłby się stosunek liczby neutronów do liczby protonów w jądrze Cu-65 gdyby uległo ono rozpadowi α, β+, β-.
14) W wyniku przemiany promieniotwórczej jądro izotopu U- 238 przekształca się w Ra-226. Ile cząstek i jakiego rodzaju emituje jądro wyjściowe? Napisać15) równania reakcji.
16) Sumaryczne, uproszczone równania reakcji rozpadu dwóch z trzech naturalnych szeregów promieniotwórczych przedstawiają się następująco: U-238 (8 α; 6β) Pb-206; U-235(7α;4β)Pb-207. Napisz równania reakcji jądrowych.
17) Jaki był typ rozpadu w następujących przykładach reakcji jądrowych: Os-185 →Ir-185; Rn-222 → Po-218; Pd –111 →Ag-111
18) Podać19) jakie pierwiastki posiadają jądra o następującym składzie: (9p, 10n); (34n, 30p); (84p, 126n); (124n, 82p)
20) Znając następujące izotopy wodoru: 1H, 2H (D), 3H(T) oraz tlenu 16O, 17O, 18O, napisać21) wszystkie możliwe wzory wody (18 wzorów) Spośród nich wybrać22) wodę „najlżejszą” i „najcięższą”, a następnie obliczyć23) ich masy molowe.
24) Wśród
podanych nuklidów wybrać25) izotopy oraz izobary:

26) Na jeden atom izotopu 37Cl przypadają, w przybliżeniu, 3 atomy izotopu 35Cl . Jakiej średniej masie atomowej odpowiada ten skład?
27) Stosunek liczb nuklidów 65Cu i 63Cu w miedzi, występujących w związkach chemicznych, wynosi 31:69. Obliczyć28) średnią masę atomową miedzi. Wynik obliczeń porównaj z wartością tabelaryczną masy atomowej.
29) Skład izotopowy talu jest następujący: 203Tl : 205Tl = 3 : 7. Obliczyć30) średnią masę atomową talu.
31) Brom zawiera 40,52% atomowych izotopu 79Br. Pozostałą część32) stanowi izotop 81Br. Obliczyć33) średnią masę atomową bromu.
34) Skład izotopowy magnezu (w procentach atomowych) jest następujący: 78,60% 24Mg; 10,11% 25Mg; 11,29% 26Mg. Ile wynosi średnia masa atomowa magnezu ?
35) Skład izotopowy antymonu jest następujący: x121Sb + y123Sb. Wyznaczyć36) wartości x i y, jeśli masa atomowa antymonu, znaleziona doświadczalnie, wynosi 121,75 u.
37) Średnia masa atomowa rubidu wynosi 85,45 u. Rubid składa się z izotopów 85Rb oraz 87Rb. Podać38) skład izotopowy pierwiastka w procentach atomowych.
39) Po upływie 55 minut z 400 mg izotopu promieniotwórczego 13N pozostało 12,5 mg. Ile wynosił okres półtrwania tego izotopu ?
40) Okres półtrwania izotopu 24Na ulegającego rozpadowi β, wynosi 14,8 godziny. Napisz równanie reakcji jądrowej. Jaka ilość41) 24Mg powstanie z 12 g 24Na: a/ po upływie 10 h; b/ po całkowitym rozpadzie promieniotwórczym tej ilości izotopu sodu.
Tags: sprawdzian z, sprawdzian, uczniów
- PETITION TO MARCH POLICY 1 A STUDENT WHO
- PROCEDURA ZWIĄZANA Z UZYSKIWANIEM BRAKUJĄCYCH OCEN DO INDEKSU ELEKTRONICZNEGO
- LOS COMITÉS DE ÉTICA ASISTENCIAL SON ÓRGANOS COLEGIADOS DE
- 4º B 20052006 1 PRESENTACIÓN 3 2 CANCIÓN
- MONTHLY BULLETIN APRIL 2013 REPORT DATE 26042013 PAGE
- BÄSTA KLIENT INOM TJÄNSTERNA FÖR PERSONER MED FUNKTIONSNEDSÄTTNING
- 3 TIPOS DE SOCIOS PARA PODER AMPARAR A LAS
- A DMINISTRATIVO JUNTA DE ANDALUCÍA SIMULACRO DE EXAMEN 12
- NATIONAL HISTORY DAY CREATING EXHIBITS ENTRIES SURVIVAL GUIDE GROUP
- ANDISOLS OF THE NILGIRI HIGHLANDS NEW INSIGHT INTO THEIR
- BADMINTON KLUB KUNGOTA TEKMOVALNI PRAVILNIK REKREATIVNE TRUMP LIGE 1
- EMERGENCY MANAGEMENT MUTUAL AID PLAN EMMA FORM 1 RESOURCE
- GOVERNMENT OF PAKISTAN PAKISTAN PUBLIC WORKS DEPARTMENT NO
- 5 LĪGUMA PROJEKTS LĪGUMS NR … PAR NEAPDZĪVOJAMU TELPU
- DIVORCIOINTERNETCOM DESDE 360€ (HONORARIOS DEL LETRADO PROCURADOR E IVA
- OMPIPIBOG06INF1 PROV PAGE 6 E OMPIPIBOG06INF1 ORIGINAL ENGLISH DATE
- UREDNIŠTVO ČASOPISA “POZNAŃSKIE STUDIA SLAWISTYCZNE” OBRAĆA SE S MOLBOM
- DÉLNYÍRSÉGI TÖBBCÉLÚ ÖNKORMÁNYZATI KISTÉRSÉGI TÁRSULÁS 4320 NAGYKÁLLÓ SOMOGYI BÉLA
- 02AMPLOS PODERES SIMPLES A QUEM CONFERE(M) AMPLOS GERAIS E
- DRUŽINSKA PRIJAVNICA RAZLOG BIVALIŠČE (KRAJ ULICA HŠT POŠTA) STANOVANJE
- ALGUNAS PLACAS PRIMERO RAGÙ INGREDIENTES PARA 4 PERSONAS 23
- 36 CULTURE AND SELFWORTH RUNNING HEAD CULTURE AND COMPARISON
- APPLICATION FORM (PLEDGE FORM) FOR WHOLE BODY DONATION NAMEFATHERHUSBANDWIFE
- SIREHO – SISTEMA DE REGISTRO DE CONTRATOS DE PRESTACIÓN
- ADMINISTRACJA PUBLICZNA PROGRAM STUDIUM OBEJMUJE I M IN NASTĘPUJĄCE
- UNIVERZITET U TUZLI ORGANIZACIONA JEDINICA ZAHTJEV ZA ODOBRAVANJE
- REQUEST FOR EXPRESSION OF INTEREST (EOI) SUBJECT ELECTRONIC EVIDENCE
- HEREFORDSHIRE INFORMATION SHARING PROTOCOL DATE ISSUED VERSION 201 LAST
- MEDICI DI MEDICINA GENERALE AMBITO TERRITORIALE VULTURE COMUNE COGNOME
- SECTION 09 90 00 PAINTING VISTA 09 90 00
 ACERCA DEL ÁNTRAX SPANISH DOXYCYCLINE ANTHRAX INFORMACIÓN LAS 24
ACERCA DEL ÁNTRAX SPANISH DOXYCYCLINE ANTHRAX INFORMACIÓN LAS 2411 (PAPEL DE TRABAJO) VISIÓN Y FUTURO DEL SECTOR
 CHAPTER THREE THIRD TRIMESTER MEASUREMENTS AN INTERINTRA SONOGRAPHER EVALUATION
CHAPTER THREE THIRD TRIMESTER MEASUREMENTS AN INTERINTRA SONOGRAPHER EVALUATION EAU DE TÓXICOS GREENPEACE ENCUENTRA SUSTANCIAS QUÍMICAS PELIGROSAS EN
EAU DE TÓXICOS GREENPEACE ENCUENTRA SUSTANCIAS QUÍMICAS PELIGROSAS EN SERVING SPANISH SPEAKING COMMUNITIES LIBRARY SELFASSESSMENT CHECKLIST NOTE
SERVING SPANISH SPEAKING COMMUNITIES LIBRARY SELFASSESSMENT CHECKLIST NOTECHAPTER 18 FOUNDATIONS OF CONTROL TRUEFALSE QUESTIONS WHAT IS
 INFORMATION CLASSIFICATION CONTROLLED APPLICATION FOR PREFERRED PAYMENT TERMS (SMALL
INFORMATION CLASSIFICATION CONTROLLED APPLICATION FOR PREFERRED PAYMENT TERMS (SMALL COMMUNITY EMERGENCY RESPONSE TEAM APPENDIX 1A HAZARD LESSON PLANS
COMMUNITY EMERGENCY RESPONSE TEAM APPENDIX 1A HAZARD LESSON PLANS DIRECCIÓN TÉCNICA INFORME FAVORABLE SOBRE EL ESTADO DE LAS
DIRECCIÓN TÉCNICA INFORME FAVORABLE SOBRE EL ESTADO DE LASŠIFRA PREDMETA 2308 NAZIV PREDMETA GENOMSKA DNA
REVISED DRAFT – 2102012 DEPARTMENT OF ENVIRONMENTAL PROTECTION BUREAU
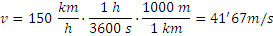 SOLUCIONES PROBLEMAS DE CINEMÁTICA 1º UN COCHE PASA POR
SOLUCIONES PROBLEMAS DE CINEMÁTICA 1º UN COCHE PASA PORDETAILS OF FOOD INDUSTRY EXPERIENCE & FOOD SECTOR
STOICHIOMETRY MOLE TO MASS PROBLEMS 1 MG(S) + 2HCL(AQ)
 CHANGE REQUEST OR VERIFICATION WARRANT (PART SUBMISSION WARRANT) PART
CHANGE REQUEST OR VERIFICATION WARRANT (PART SUBMISSION WARRANT) PART COMMUNICATIONS PLAN PREPARING THE PUBLIC TO ACT IN CASE
COMMUNICATIONS PLAN PREPARING THE PUBLIC TO ACT IN CASE 28 SVERIGES GRODOR OCH PADDOR © SIMON KÄRVEMO
28 SVERIGES GRODOR OCH PADDOR © SIMON KÄRVEMO« ENTÊTE CABINET CONSEIL » VILLE………………… DATE………………………… « NOM
OPIS PROGRAMU KSZTAŁCENIA KIERUNEK PEDAGOGIKA STOPIEŃ DRUGI 1 NAZWA
 ALBACETE NIG PROCEDIMIENTO DERECHOS FUNDAMENTALES 0000432 2012 SOBRE
ALBACETE NIG PROCEDIMIENTO DERECHOS FUNDAMENTALES 0000432 2012 SOBRE