PAU – SELECTIVIDAD PAU – TEMA8 REACCIONES DE
PRUEBA DE SELECTIVIDAD CURSO 201516 ESTRUCTURA1 PREGUNTAS SELECTIVIDAD TEMA3 1 DEFINE LOS SIGUIENTES
38 TEXTOS DE SELECTIVIDAD DE MADRID 2010 2011
EJERCICIOS DE SELECTIVIDAD BLOQUE PRINCIPIOS DE MÁQUINAS 1 UN
EJERCICIOS DE SELECTIVIDAD EQUILIBRIO QUÍMICO 1ºDADO EL EQUILIBRIO SEÑALE
Ejercicios Selectividad Zaragoza Cinética Química Junio 2008 Opción
PAU – Selectividad
PAU – Selectividad
PAU – TEMA8. REACCIONES DE TRANSFERENCIA DE PROTONES
1.- Se dispone de 0,5 L de una disolución acuosa 0,1 M de un ácido débil HA, que se disocia un 5%.
Calcula el valor de la constante de disociación del ácido y el pH de la disolución.
¿Qué volumen de la disolución del ácido se necesita para neutralizar una disolución que contiene 0,2 gramos de hidróxido de sodio?
Datos.- Masas atómicas: H = 1,0; Cl = 35,5; Na = 23,0; O = 16,0
2.- Se preparan cuatro disoluciones diluidas independientes disolviendo la misma cantidad de moles por litro de cada uno de los siguientes ácidos: HCN (Ka = 7,2·10-10), HAc (Ka = 1,8·10-5), HF (Ka = 5,6·10-4) y HClO (Ka = 3,0·10-8).
Ordena las disoluciones de mayor a menor pH.
Ordena las disoluciones de mayor a menor concentración de ácido sin disociar.
Escribe las bases conjugadas de estos ácidos y ordénelas de mayor a menor carácter básico.
3.- A una disolución 0,01M de un ácido monoprótico le corresponde un grado de disociación de 0,98.
Explica razonadamente si son ciertas o no las siguientes afirmaciones:
se comporta prácticamente como un ácido fuerte
el pH de la disolución debe ser aproximadamente cero
el ácido está poco disociado
su base conjugada debe ser muy débil.
4.- Se dispone de una disolución acuosa que en el equilibrio tiene 0,2 M de ácido fórmico (ácido metanoico), cuya concentración en protones es 10–3 M.
Calcule qué concentración de ion formiato tiene dicha disolución.
Calcule la constante de basicidad del ion formiato o metanoato. ¿Es una base débil o fuerte?
¿Cuántos mililitros de ácido clorhídrico 0,1 M habría que tomar para preparar 100 mL de una disolución del mismo pH que la disolución 0,2 M de ácido fórmico.
Dato: Ka ácido fórmico = 2·10–3
5.- Justifique con cuál de las dos especies químicas de cada apartado, reaccionará el HF(acuoso) en mayor medida. Escriba las reacciones correspondientes:
NO3- o NH3
Cl- o NaOH
Mg(OH)2 o H2O
CH3-COOH o CH3-COO-
Datos.- Ka(HF) =6.10-4, Kb(NH3) = 1,8.10-5, Ka (HAc)= 1,85.10-5
6.-Una disolución acuosa de amoníaco de uso doméstico tiene de densidad 0,85 g·cm–3 y el 8 % de NH3 en masa.
Calcule la concentración molar de amoníaco en dicha disolución.
Si la disolución anterior se diluye 10 veces, calcule el pH de la disolución resultante.
Determine las concentraciones de todas las especies (NH3, NH4+, H+ y OH–) en la disolución diluida 10 veces.
Datos.- Masas atómicas: N = 14, H = 1; Kb NH3 = 1,8·10–5
Solución:
1.-
a) HA A- + H+
ceq c(1-α) cα cα
ceq 0,1·(1-0,05) 0,1·0,05 0,1·0,05
Ka = (0,1·0,05)2/0,1·(1-0,05) = 2,6·10-4
b) NaOH Na+ + OH-;disociación completa nº moles OH- = 0,2/40 = 0,005
necesarios 0,005 moles de ácido AH; nº moles = M·V 0,005 = 0,1·V V = 0,05 L
2.-
Cuanto mayor sea Ka mayor será grado de disociación y mayor [H+], ya que todas tienen igual concentración inicial de ácido. A mayor [H+] menor pH. Luego la de mayor pH será la de menor Ka.
Orden de pH: HCN > HClO > HAc > HF
Cuanto mayor sea Ka mayor será grado de disociación y menor será [AH].
Orden de concentración de ácido: HCN > HClO > HAc > HF
Ácidos Bases conjugadas
HCN H+ + CN-
HAc H+ + Ac- Cuanto mayor es Ka, menor es Kb
HF H+ + F- Al ácido menos débil le corresponde la base conjugada mas débil.
HClO H+ + ClO-
Orden de basicidad de las bases conjugadas:CN- > ClO- > Ac- > F-
3.-
Sí, dado que un ácido fuerte, HA, está completamente disociado y en este caso el grado de disociación es prácticamente 1.
No, el pH de la disolución será aproximadamente 2.
No, el valor grande del grado de disociación indica que está muy disociado.
Sí, si el ácido, HA, es fuerte la base conjugada, A-, debe ser muy débil y el equilibrio A- + H2O HA + OH-, está muy desplazado hacia la izquierda.
4.-
a)
![]()
![]() ;
;
![]() =
0,4 M
=
0,4 M
b) ![]() Kb
es muy baja, luego es una base débil.
Kb
es muy baja, luego es una base débil.
c) HCl
H+
+ Cl-
;
![]() =
10-3
M (es decir pH 3); c·V = c´·V´; V·0,1
= 100·10-3;
V = 1 mL
=
10-3
M (es decir pH 3); c·V = c´·V´; V·0,1
= 100·10-3;
V = 1 mL
5.- Solución:
a) Como el HF es un ácido débil (Ka=6·10-4) reaccionará con NH3 que es una base débil (Kb=1,8·10-5) : HF + NH3 F- + NH4+
Con el NO3- no reacciona al proceder de un ácido fuerte.
Reacciona con NaOH (base fuerte):
HF + NaOH NaF + H2O
Con el Cl- no reacciona prácticamente al proceder de un ácido fuerte.
Reacciona en mayor medida con Mg(OH)2 (base fuerte):
2HF + Mg(OH)2 MgF2 + 2H2O
Con el agua también reacciona:
HF + H2O F- + H3O+
Reacciona con el ion CH3COO- (acetato) que es una base débilen lugar del CH3COOH que es un ácido débil
HF + CH3-COO- F- + CH3-COOH
6.-
a) [NH3] = [(850 0,08) / 17] / 1 = 4 M
b) Al diluir 10 veces, [NH3] = 4 / 10 = 0,4 M
NH3 + H2O NH4++ OH– (o también NH4OH NH4+ + OH–)
0,4 – x x x
Kb = [NH4+] [OH–] / [NH3]; 1,8·10–5 = x2 / (0,4 – x); como x despreciable frente a 0,4
x = [OH–] = 2,68·10–3 M; pOH = 2,57; pH = 14 – 2,57 = 11,43
c) [NH3] = 0,397 M 0,4 M; [NH4+] = [OH–] = 2,68·10–3 M; [H+] = 3,72·10–12 M
EJERCICIOS SELECTIVIDAD ZARAGOZA EL ÁTOMO SEPTIEMBRE 2000 OPCIÓN
EJERCICIOS SELECTIVIDAD ZARAGOZA EQUILIBRIO QUÍMICO Y PRODUCTO DE
EJERCICIOS SELECTIVIDAD ZARAGOZA ESTEQUIOMETRÍA DISOLUCIONES GASES DETERMINACIÓN FÓRMULAS
Tags: reacciones de, las reacciones, reacciones, tema8, selectividad
- ACCESUL LA INFORMATIILE DE INTERES PUBLIC “ACCESUL LIBER SI
- 4 RADA NADZORCZA WĘGLOKOKS ENERGIA ZUT SP Z
- RESUM ORDE CONVOCATÒRIA PLA 20132016 AJUDES A LA REHABILITACIÓ
- ОТЧЕТ ПО РЕЗУЛЬТАТАМ САМООБСЛЕДОВАНИЯ ОБРАЗОВАТЕЛЬНОЙ ОРГАНИЗАЦИИ ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ
- PAOLUCCI SIGNORINI MARISALDI IL RACCONTO DELLO STORICO SEZIONE A
- CONSOLIDADO DE ENTREVISTAS – MAYO 2010 NOMBRE DEL POSTULANTE
- ÇALIÅX9EANLARIN Ä°ÅX9E SAÄX9ELIÄX9EI VE GÃŒVENLÄ°ÄX9EÄ° EÄX9EÄ°TÄ°MLERÄ°NÄ°N USUL VE ESASLARI
- 22ND ANNUAL EFVET INTERNATIONAL CONFERENCE THE COLLEGE THAT WORKS!!!
- ANEXA III MACHETA PENTRU PUBLICAREA INFORMAȚIILOR PRIVIND EXERCITAREA OPȚIUNILOR
- ALL CORRESPONDENCE TO MEAT & LIVESTOCK AUSTRALIA LIMITED ABN
- DOMINGO 19 FEBRERO 2006 EDICIÓN DIGITAL N 2625 PORTADA
- FECHA 29 JUNIO7 JULIO 2016 ASUNTO V CAMPUS INNOVACIÓN
- LÍMITES DE EXPOSICIÓN PROFESIONAL PARA AGENTES QUÍMICOS EN ESPAÑA
- AMHERST RECREATION DEPARTMENT 4 CROSS ROAD AMHERST NH 03031
- C 100 MARTINE AVENUE WHITE PLAINS NY 9144221480 WWWWHITEPLAINSLIBRARYORG
- STUDENT APPLICATION FORM APPLICATION DEADLINES PROGRAM SPACE
- UICN UNION INTERNATIONALE POUR LA CONSERVATION DE LA NATURE
- ORACLE® HYPERION FINANCIAL CLOSE MANAGEMENT RELEASE 11121102 (PSU2) INTEGRATION
- FAMILY GROUP CONFERENCE POLICY AND PROCEDURE 1 PURPOSE
- INCREASING ACCESS TO MEDICATIONASSISTED TREATMENT FOR OPIOID ADDICTION IN
- NA PODLAGI PRAVILNIKA O PRILAGAJANJU ŠOLSKIH OBVEZNOSTIH (URADNI
- 7 STUDI PROBLEM SOLVING WAKTU PENGERJAKAN WIGGLY BLOCK WILIS
- EJERCICIO DE ATENCIÓN Y CONCENTRACIÓN TEST DE TRES MINUTOS
- EFECTO FOTOELÉCTRICO ANTECEDENTES MAXWELL ENTRE 1864 Y 1873
- TOPIC EXPLORATION PACK FOREIGN EXCHANGE THIS TOPIC
- DATASET SUBLICENCE AGREEMENT FOR [PRODUCT] JISC SERVICES LIMITED (OPERATING
- ESKOLA KIROLA PARTE HARTZEKO IBILBIDEA ESKUA 201920 DEPORTE
- MIGRATION POPULATION AND DEVELOPMENT IN THE EUROMEDITERRANEAN AREA
- L O Y I H A O‘ZBEKISTON RESPUBLIKASI XALQ
- ARREGLA AL HOMBRE Y ARREGLARÁS EL MUNDO UN CIENTÍFICO
Surface Drifter Pathways Originating in the Equatorial Atlantic Cold
 RECTANGLE 36 THE ASU FACULTY RELEASE PROGRAM FOR RESEARCH
RECTANGLE 36 THE ASU FACULTY RELEASE PROGRAM FOR RESEARCHDUE DATE DECEMBER 10 5 PM [ NO
 JUGULE ! SIMULATION DE COMBATS DE GLADIATEURS DANS LA
JUGULE ! SIMULATION DE COMBATS DE GLADIATEURS DANS LAFICHA B TB SECRETARIA MUNICIPAL DE SAÚDE SISTEMA
GUÍA 1 SILVICULTURA URBANA EN LA CIUDAD DE MÉXICO
 FORMULARIO DE SOLICITUD DE FINANCIAMIENTO PARA FACILITAR LA PARTICIPACION
FORMULARIO DE SOLICITUD DE FINANCIAMIENTO PARA FACILITAR LA PARTICIPACION A KONTROLLOBJEKT NAMN OCH ADRESS TELEFONNUMMER (DAGTID) MOBILTELEFONNUMMER KONTROLLPROTOKOLL
A KONTROLLOBJEKT NAMN OCH ADRESS TELEFONNUMMER (DAGTID) MOBILTELEFONNUMMER KONTROLLPROTOKOLLFOR IMMEDIATE PRESS RELEASE 7TH OCTOBER 2008 EATJAPAN SUSHI
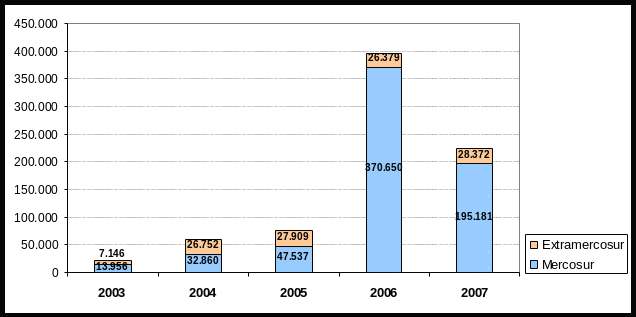 INFORME DE LA SESIÓN ANUAL SOBRE LA IMPLEMENTACIÓN DEL
INFORME DE LA SESIÓN ANUAL SOBRE LA IMPLEMENTACIÓN DEL ZWEI WOCHEN VOR DEM TAG DER VOLLVERSAMMLUNG AUF DER
ZWEI WOCHEN VOR DEM TAG DER VOLLVERSAMMLUNG AUF DERBABICASVETUJE NAPITEK PROTI HOLESTEROLU NARIBAMONAREŽEMO 20 DAG ČEBULE 20
 M INISTERIO DE COMERCIO EXTERIOR Y TURISMO PLAN OPERATIVO
M INISTERIO DE COMERCIO EXTERIOR Y TURISMO PLAN OPERATIVO HISTÒRIA DE LA INFORMÀTICA I LES TELECOMUNICACIONS LA XARXA
HISTÒRIA DE LA INFORMÀTICA I LES TELECOMUNICACIONS LA XARXA JOB ORDER FORM PLEASE FAX TO 13108309516 ATTENTION CHARLOTTE
JOB ORDER FORM PLEASE FAX TO 13108309516 ATTENTION CHARLOTTEZ M L U V A Č O ODVÁDZANÍ
KATARINA JEREMIĆ VAN PROF SPISAK 10 REFERENTNIH RADOVA 1
NAKNADNE LOKALNE VOLITVE ZA ČLANA OBČINSKEGA SVETA PREDSTAVNIKA
LEY DE LOS DELITOS ADUANEROS LEY Nº 28008 CONCORDANCIAS
CHAPTER 8 SOLUTIONS TEST BANK TYPE