PROPIEDADES DE LA MATERIA CUESTIONES GENERALES 1 A) LA
OBJETIVO ESTUDIAR AQUELLAS PROPIEDADES DE LA MATERIA SUJETA13 PROPIEDADES Y FUNCIONES DEL LENGUAJE ¿RECUERDA USTED TODAVÍA
26 PROPIEDADES MECÁNICAS DEL SUELO Y DEL NEUMÁTICO REFERIDAS
6 ESTRUCTURA MOLECULAR Y SU RELACIÓN CON LAS PROPIEDADES
ACTIVIDAD LAS PROPIEDADES DEL SUELO HABILIDADES LLEVAR A
ACTIVIDADES IDENTIFICANDO PROPIEDADES DE LAS POTENCIAS SIMÓN Y ANTONIA
Ejercicios Redox
PROPIEDADES de la materia.
Cuestiones generales.
a) La relación q/m de los rayos catódicos, ¿depende del gas que haya encerrado en el tubo? b)¿Y la de los rayos canales (anódicos)? Justifica las respuestas.
Razona si son verdaderas o falsas las siguientes afirmaciones: a) cuando un electrón pasa de un estado fundamental a un excitado emite energía; b) la energía de cualquier electrón de un átomo es siempre negativa; c) En el espectro de absorción los electrones pasan de un estado fundamental a uno excitado y E > 0.
Conteste breve y razonadamente lo que se plantea en los apartados siguientes: a) ¿Qué son los modelos atómicos y qué utilidad tienen? b) Cite dos modelos atómicos que sirvan para indicar la situación energética del electrón. c) ¿La distribución de todas las partículas que forman parte del los átomos está descrita por los modelos atómicos que ha descrito en el apartado b)? d) Explique si hay diferencia entre órbita y orbital. (Selectividad Madrid. Reserva 1996).
Radiación electromagnética.
El color amarillo de la luz de sodio posee una longitud de onda de 5890 Å. Calcula la diferencia energética correspondiente a la transición electrónica que se produce expresada en eV. (h = 6,626 · 10–34 J·s; 1 eV = 1,602 · 10-19 J)
Calcula la energía emitida por 0,2 moles de fotones producidos por radiaciones de 60 s–1.
Qué energía cinética tendrán 1 mol de electrones desprendidos de la superficie metálica del sodio al iluminar ésta con radiación suficiente de 4800 Å si sabemos que la frecuencia umbral del sodio es de 5 · 10 14 s–1. (1 Å = 10-10 m)
Calcula: a) la energía de un fotón cuya longitud de onda es de 5500 Å. b) la energía de un mol de fotones.
Calcula la energía de un fotón de una lámpara de vapor de mercurio cuya longitud de onda es de 546 nm.
Calcula frecuencia y la longitud de onda de la radiación emitida por un electrón que pasa del estado excitado cuya energía es de –3,4 eV al estado fundamental de energía ‑13,6 eV.
La capa de ozono absorbe la radiaciones ultravioleta, capaces de producir alteraciones en las células de la piel, cuya longitud de onda está comprendida entre 200 y 300 nm. Calcular la energía de un mol de fotones de luz ultravioleta de longitud de onda 250 nm. Solución: 4,79 · 105 J.
Números cuánticos
a) Enuncia el principio de mínima energía, la regla de máxima multiplicidad y el de principio de exclusión de Pauli; b) cuál/es de las siguientes configuraciones electrónicas no son posibles de acuerdo con este último principio (exclusión Pauli): 1s23s1; 1s22s22p7; 1s22s22p63s3; 1s22s22p1.
Responde razonadamente a: a) ¿Los orbitales 2px, 2py y 2pz tienen la misma energía?; b) ¿Por qué el número de orbitales “d” es 5? (Selectividad COU. Murcia Junio 1998).
El grupo de valores 3,0,3, correspondientes a los números cuánticos n, l y m, respectivamente, ¿es o no permitido? ¿Y el 3,2,–2? Justifica la respuesta.
Indica los números cuánticos de cada unos de los 3 últimos e– del P.
Indica el valor de los cuatro números cuánticos de cada uno de los electrones del átomo de titanio neutro (Z = 22)
Indica el valor de los números cuánticos de cada uno de los seis últimos electrones del Mo (Z = 42).
Justifica si es posible o no que existan electrones con los siguientes números cuánticos: a) (3, –1, 1, –½); b) (3, 2, 0, ½); c) (2, 1, 2, ½); d) (1, 1, 0, –½).
Justifica si es posible o no que existan electrones con los siguientes números cuánticos: a) (2, –1, 1, ½); b) (3, 1, 2, ½); c) (2, 1, –1, ½); d) (1, 1, 0, –2) (Cuestión Selectividad La Laguna Junio 1997).
SOLUCIONES (Termoquímica)
No, puesto que los rayos catódicos son electrones y éstos tienen la misma carga y la misma masa, independientemente del gas del que sean expulsados.
Sí, puesto que los rayos anódico o canales, son núcleos atómicos y su mansa depende del número de protones y neutrones, mientras que su carga depende sólo del número de protones que tenga.
FALSA. Si sube a un nivel de mayor energía , absorberá energía.
VERDADERO. Se considera 0 la energía del electrón cuando abandona el átomo.
VERDADERO. Puesto que la energía el estado excitado es mayor que la del estado fundamental E > 0.
Son manera de representar la forma y partes constituyentes del átomo. Son útiles en tanto tienen a hacernos una idea de cómo son en la realidad, puesto que que intentan explicar las propiedades vistas en ellos.
Modelo de Bohr y modelo mecanocuántico.
Solo se describen las partículas fundamentales del átomo: protones, neutrones y elctrones.
Órbita es una trayectoria perfectamente definida, mientras que orbital es la zona alrededor del núcleo en donde puede encontrarse a un electrón; normalmente se representa la zona de máxima probabilidad de encontrarlo; es por tanto, una parte del espacio sin límites fijos.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
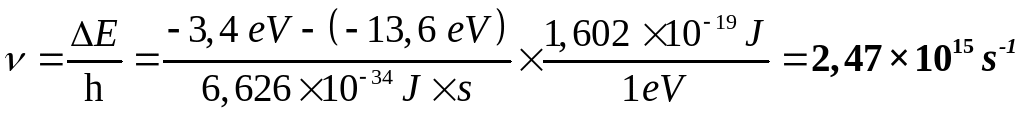
![]()
![]()
Mínima energía: Los e–
se sitúan en los orbitales de menor energía posible
hasta ir completando éstos,
Máxima
multiplicidad: Cuando hay varios orbitales con la misma
energía, los e– se sitúan de manera
que se encuentren desapareados, no llenándose los segundos e–
hasta que se haya completado un e– en cada orbital
de igual energía.
Exclusión de Pauli:
“No puede haber dos electrones con los cuatro números
cuánticos iguales”.
1s22s22p7: No es posible, ya que en orbitales p (l=1) y m toma tres valores: -1.0 y 1, y como s solo toma dos valores posibles, únicamente puede haber 6 e– que tengan los cuatro número cuánticos distintos.
1s22s22p63s3: No es posible, ya que en orbitales s (l=0) y m toma un solo valor: 0, y como s solo toma dos valores posibles, únicamente puede haber 2 e– que tengan los cuatro número cuánticos distintos.
Si tienen la misma energía. Sólo al aplicar un campo magnético se desdoblan según la dirección de éste.
Porque en orbitales “d” l =2 y “m” toma cinco valores posibles: –2, –1, 0, +1 y +2 correspondientes a los cinco orbitales.
3,0,3: No permitido. Pues si l=0, entonces m solo puede tomar el valor 0. (–l m +l).
3,2,–2: Sí permitido. Puesto que l < n y l=2, con lo que m puede tomar los valores:-2, -1, 0, +1 y +2.
Z (P) = 15. Configuración electrónica: 1s2 2s2p6 3s2p3
n = 3; l = 1; m = –1; s = –½; n = 3; l = 1; m = 0; s = –½; n = 3; l = 1; m = +1; s = –½;
n = 1; l = 0; m = 0; s = –½; n =
1; l = 0; m = 0; s = +½;
n = 2; l = 0; m = 0; s = –½;
n = 2; l = 0; m = 0; s = +½;
n = 2; l = 1; m = –1;
s = –½; n = 2; l = 1; m = 0; s = –½;
n = 2; l = 1; m = +1; s = –½;
n = 2; l = 1; m = –1;
s = +½; n = 2; l = 1; m = 0; s = +½; n = 2; l =
1; m = +1; s = +½;
n = 3; l = 0; m = 0; s = –½;
n = 3; l = 0; m = 0; s = +½;
n = 3; l = 1; m = –1;
s = –½; n = 3; l = 1; m = 0; s = –½;
n = 3; l = 1; m = +1; s = –½;
n = 3; l = 1; m = –1;
s = +½; n = 3; l = 1; m = 0; s = +½; n = 3; l =
1; m = +1; s = +½;
n = 4; l = 0; m = 0; s = –½;
n = 4; l = 0; m = 0; s = +½;
n = 3; l = 2; m = –2;
s = –½; n = 3; l = 2; m = –1; s = –½
Z (Mo) = 42. Configuración electrónica: [Kr] 5s2 4d4
n = 5; l = 0; m = 0; s = –½; n =
5; l = 0; m = 0; s = +½;
n = 4; l = 2; m = –2; s =
–½; n = 4; l = 2; m = –1; s = –½;
n = 4; l = 2; m = 0; s = –½; n = 4; l = 2; m =
+1; s = –½;
a) (3, –1, 1, –½); NO. Porque l no puede tomar valores negativos.
b) (3, 2, 0, ½); SÍ. l <n; –l m +l; s (–½, ½ ). Orbital 3d
c) (2, 1, 2, ½); NO. Porque m > l
d) (1, 1, 0, –½). NO. Porque l = n y debe ser menor.
a) (2, –1, 1, ½); NO. Porque l no puede tomar valores negativos.
b) (3, 1, 2, ½); NO. Porque m > l
c) (2, 1, –1, ½); SÍ. l <n; –l m +l; s (–½, ½ ). Orbital 2p
d) (1, 1, 0, –2) NO. Porque l = n y debe ser menor y s (–½, ½ ).
Soluciones a los ejercicios de los apuntes:
![]()
Efotón= h x n = 6,625 x 10–34 J s x 3,5 x 1017 s–1 = 2,34 x 10–19 J
Como esta energía es inferior a la energía umbral el electrón no saldrá expulsado.
No tiene sentido emplear
![]() puesto que daría energía cinética negativa.
puesto que daría energía cinética negativa.
a) “n” (nº cuántico principal) es el nº de capa o nivel en la que está situado el e–.“l” (nº cuántico secundario) representa el tipo de orbital: s, p, d o f.“m” (nº cuántico magnético) indica la orientación espacial del orbital. “s” (spín) indica el sentido de giro del e–.
b) “No puede haber dos electrones con los cuatro números cuánticos iguales”
c) “3p” : n = 3; l = 1; m = –1,0,+1; 3
orb. 6 e–.
“3d” : n = 3; l = 2; m = –2,– 1,0,+1,+2; 5
orb. 10 e–.
d) (1,0,0,½)
1s
(4,1,0,½)
4p (uno de los tres existentes, 4py por ejemplo).
ACTIVIDADES PROPIEDADES DE LAS POTENCIAS DE BASE Y EXPONENTE
AIRE HUMEDO 1 ENUMERE TODAS LAS PROPIEDADES QUE
ALDEHÍDOS Y CETONAS 1 INTRODUCCIÓN 2 PROPIEDADES FÍSICAS
Tags: cuestiones generales., generales, propiedades, materia, cuestiones
- 9 TITLE RECOGNIZING GOD’S PROVISION TEXT 2 PETER 1211
- BABYGO BAMBOO SERVICE FÜR KINDER PRODUKTBESCHREIBUNG DAS KINDERGESCHIRR AUS
- UNA NUEVA MIRADA SOBRE LA DISCAPACIDAD CONVENCIÓN SOBRE LOS
- TIESAS SPRIEDUMS (SESTĀ PALĀTA) 1994 GADA 12 APRĪLĪ HALLIBURTON
- BACK TO GEORGE BENNETT’S HOMEPAGE BACK TO BENNETTEATON GENEALOGY
- CHAPTER 4 INDIVIDUAL AND MARKET DEMAND CHAPTER 4 INDIVIDUAL
- “SON POBRES PORQUE NO TRABAJAN” ARACELI DAMIÁN EXISTEN VARIAS
- BIOL 515 LANDSCAPE ECOLOGY AND MANAGEMENT FALL 2011 LAB
- INFORME RAONAT SOBRE LA IDONEÏTAT DEL MEMBRE PROPOSAT PER
- 1 CALENDARIO DE DESARROLLO DEL PROGRAMA MARTA ARACELI L
- AMEND SECTION 616 SPRINKLER SYSTEM TO READ AS
- 01 DE ENERO DE 2007 DIARIO OFICIAL ACUERDO POR
- DEMANDE D’ADMISSIBILITÉ FAMILLE AVEC ENFANT PROGRAMME ACCÈS FAMILLE RVQ
- PRELIMINARY INSTRUCTIONS TO THE JURY IN A CIVIL CASE
- OCCUPATIONS CODE TITLE 6 REGULATION OF ENGINEERING ARCHITECTURE LAND
- ORDINANCE NO 9384 (NEW SERIES) AN ORDINANCE ADDING SECTION
- UNA MIRADA CRÍTICA SOBRE LA IDEOLOGÍA DE LOS TEXTOS
- LA POBREZA EN MÉXICO SEGÚN LA CEPAL ARACELI DAMIÁN
- ESTE MENSAJE ESTÁ DISPONIBLE EN ESPAÑOL E INGLÉS |
- CERTIFICADO DE RECEPCIÓN DE FONDOS Nº EXPEDIENTE TR
- PERANGKAT AJAR BANTU PELAJARAN BIOLOGI UNTUK SISWA SMA KELAS
- DEPT POLICY & CONTRACTS INTERVIEWEE FLORENCE SERRA &
- GÉNERO Y POBREZA EN AMÉRICA LATINA ARACELI DAMIÁN EN
- AHRC25G2 联 合 国 AHRC25G2 大 会 DISTR GENERAL
- MAG MATO GOSTIŠA NOVA DRUŽBENA ODGOVORNOST PODJETIJ – NOVA
- 16 RESPONSABILIDAD PROFESIONAL PROFESIONES ESPECIFICADAS INCORPORADA AL DEPÓSITO
- A532 ANNEX CURRICULUM VITAE OF DR FRANCIS GURRY DATE
- UNA MIRADA A MADRE ALBERTA A TRAVÉS DE LA
- SYNTACTIC AND PRAGMATIC FUNCTIONS OF KUKICHIN VERBAL STEM ALTERNATIONS
- FICHA DE DATOS SOCIO EMPRESAS INTERESADAS EN SER
ANSCHAFFUNG AUFSTELLUNG UND INBETRIEBNAHME EINER MASCHINE 1 ANSCHAFFUNG A
NAPOMINJEMO DA JE OVAJ OBRAZAC UGOVORA ISKLJUČIVO DAN KAO
 ATMOSFÉRA VZNIK ATMOSFÉRY – PRVOTNÁ ATMOSFÉRA TVORENÁ OXIDOM
ATMOSFÉRA VZNIK ATMOSFÉRY – PRVOTNÁ ATMOSFÉRA TVORENÁ OXIDOM LENGUA CASTELLANA Y LITERATURA I Y II INTRODUCCIÓN LA
LENGUA CASTELLANA Y LITERATURA I Y II INTRODUCCIÓN LA AN AFRICAN UNION GOVERNMENT PERSPECTIVES BY THE SOUTH AFRICAN
AN AFRICAN UNION GOVERNMENT PERSPECTIVES BY THE SOUTH AFRICAN BUREAU OF ALCOHOLIC BEVERAGES AND LOTTERY OPERATIONS DIVISION OF
BUREAU OF ALCOHOLIC BEVERAGES AND LOTTERY OPERATIONS DIVISION OFGOVERNANCE & NOMINATIONS COMMITTEE CONSTITUTION – 202122 REPORTING TO
STRANA 6 6 NÁJEMNÍ SMLOUVA NÁJEM BYTU ÚČASTNÍCI
NOTA DE DECLARACIÓN JURADA – SOCIEDADES DE HECHO ACTIVIDAD
 TRATTAMENTO COMBINATO EPOREXLINFODRENAGGIO NEL TRATTAMENTO DI ADIPOSITA’ LOCALIZZATA E
TRATTAMENTO COMBINATO EPOREXLINFODRENAGGIO NEL TRATTAMENTO DI ADIPOSITA’ LOCALIZZATA E STAV KVALITY OVZDUŠÍ V LIBERCI ÚVOD 1 MONITORING OVZDUŠÍ
STAV KVALITY OVZDUŠÍ V LIBERCI ÚVOD 1 MONITORING OVZDUŠÍDEPOSITOS EN GARANTIAS DEPÓSITO EN EFECTIVO BANCO MACRO
 APPLICATION FOR PARTICIPATION IN THE ILC PROGRAM ILC 120021
APPLICATION FOR PARTICIPATION IN THE ILC PROGRAM ILC 120021 PREPARATION OF PAPERS FOR THE ICCE DIGEST OF
PREPARATION OF PAPERS FOR THE ICCE DIGEST OFREQUISITOS PARA LA INSCRIPCIÓN PLANILLA DE SOLICITUD DE INSCRIPCIÓN
 5 LICEO TECNICO PROFESIONAL FERNANDO BINVIGNAT MARIN ROL BASE
5 LICEO TECNICO PROFESIONAL FERNANDO BINVIGNAT MARIN ROL BASE……………………………………………………… AİLE SAĞLIĞI MERKEZİ AŞILARIN SAKLANMASI VE TRANSFERİ TALİMATI
INVERSIONES EXTRANJERAS EN ESPAÑA INDICE PRIMERO GENERALIDADES I
 INSTALLATION REQUIREMENTS SECTION E ATTTP76301 AT&T INTERNET SERVICES OCTOBER
INSTALLATION REQUIREMENTS SECTION E ATTTP76301 AT&T INTERNET SERVICES OCTOBER TALENTO HUMANO ADMINISTRACIÓN DE LA COMPENSACIÓN SALARIAL CÓDIGO
TALENTO HUMANO ADMINISTRACIÓN DE LA COMPENSACIÓN SALARIAL CÓDIGO