1 UNA DISOLUCIÓN DE 7755 G DE UN COMPUESTO
Solicitud de Inscripción de Disolución de Asociación (regulada por
(1,75) 1
1.- Una disolución de 7,755 g de un compuesto orgánico en 500 g de H20 congela a 272’98 K. Calcular la masa molecular de este compuesto, sabiendo que la constante crioscópica del agua es 1,860. Si su fórmula empírica es C2H3O, escribir su fórmula molecular.
Datos: la temperatura de fusión del agua es 273,15 K.
2.- Determinar la composición de una mezcla de cloruro y bromuro de sodio de masa 2,151 g, si al reaccionar con nitrato de plata se obtienen 4,932 g de una mezcla de cloruro y bromuro de plata.
Mm(NaCl) = 58,5; Mm(NaBr) = 102,9; Mm(AgCl) = 143,3; Mm(AgBr) = 187,8.
3.- El etiquetado de un frasco de ácido sulfúrico nos indica que se trata de una disolución al 61,54% en masa y de densidad 1,515 g/mL. Calcular:
a) Molaridad.
b) Molalidad.
c) Normalidad del ácido.
d) Fracción molar del soluto.
e) ¿Cómo se prepararían 250 mL de una disolución 0,4 M de este ácido a partir de esta disolución?
Datos: MA(H) = 1 u/átomo; MA(S) = 32 u/átomo; MA(O) = 16 u/átomo.
4.- En un matraz de 10 L a 20ºC, en el que se ha realizado el vacío, se introducen 4,0 g de oxígeno, 4,0 g de nitrógeno y 4,0 g de dióxido de carbono. Calcula:
a) La presión parcial de cada gas en la mezcla.
b) La presión que ejercería la mezcla de gases si se elevara la temperatura a 60ºC.
Datos: R = 0,082 atm·L/K·mol; MA(O) = 16 u/átomo; MA(N) = 14 u/átomo; MA(C) = 12 u/átomo.
3.-
a)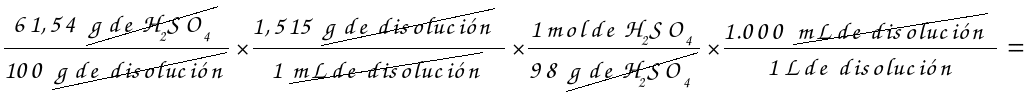 =
9,51 M
=
9,51 M
b)
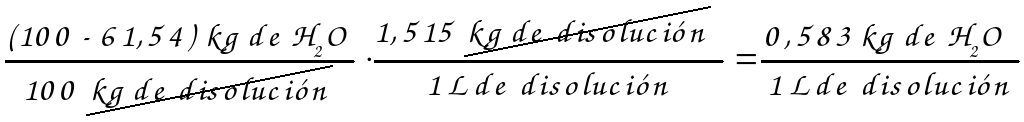
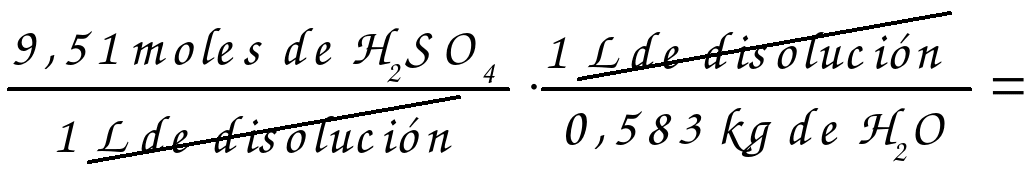 16,32
m
16,32
m
c)
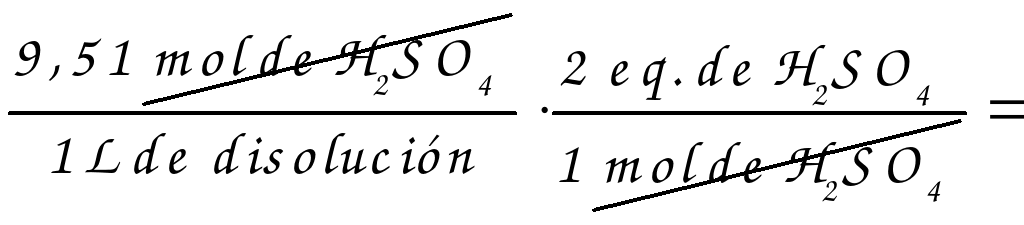 19,02
N
19,02
N
d)
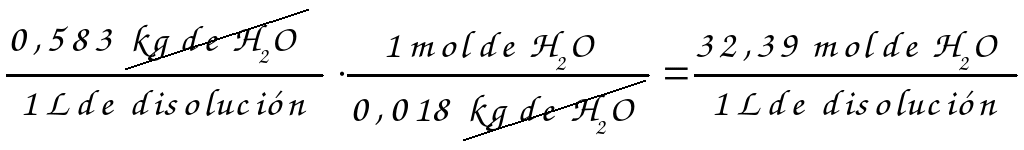
![]() 0,227
0,227
e) M·V = M’ · V’ 9,51 ·V = 0,4 · 250 V = 10,5 mL
Se tomarían 10,5 mL de la disolución y se echarían con una pipeta a un matraz aforado de 250 mL, que se rellenaría con agua hasta la marca.
4.-
V = 10 L Se utiliza la ecuación de los gases ideales:
T = 293 K p · V = n ·
R · T
![]()
a) La presión parcial de cada gas se puede obtener a partir de su cantidad de sustancia:
O2
![]() 0,300
atm
0,300
atm
N2
![]() 0,343
atm
0,343
atm
CO2
![]() 0,218
atm
0,218
atm
b) Se calcula primero el número de moles totales:
nT
=![]() =
0,359 moles totales
=
0,359 moles totales
T = 333 K
![]() 0,980 atm
0,980 atm
1.-
Tf(H2O) = 273,15 K
Tf(disolución) = 272,98 K
Kc = 1,860 K·m-1
msoluto = 7,755 g
mdisolvente = 0,500 kg
Fórmula empírica: C2H3O Mm = 43 g/mol
Al disolver un sólido en un líquido disminuye su temperatura de fusión:
Tf = Kc· m
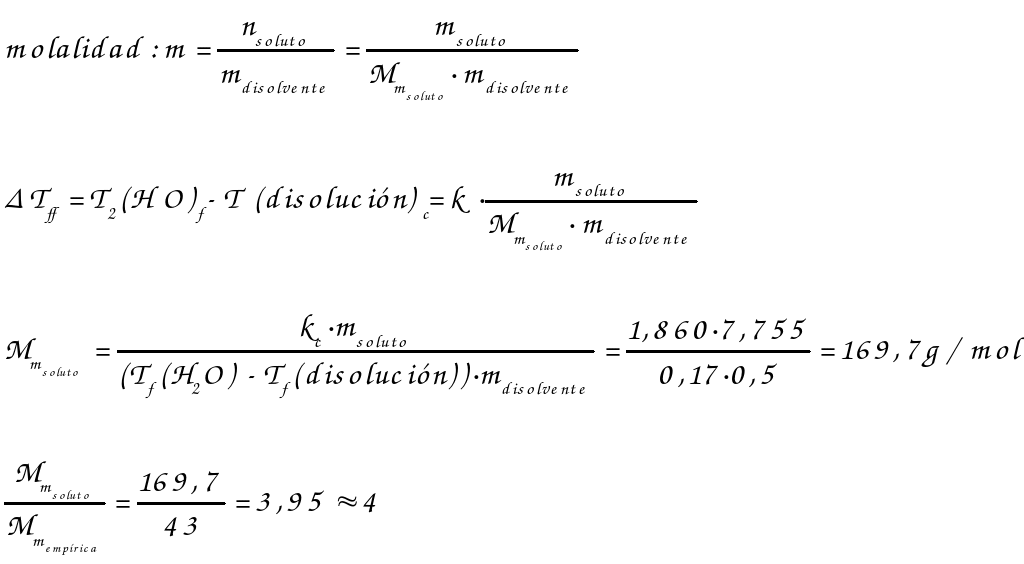
Fórmula molecular: C8H12O4.
2.-
mNaBr + mNaCl = 2,151
mAgBr + mAgCl = 4,932
NaBr(ac) Na+(ac) + Br-(ac)
NaCl(ac) Na+(ac) + Cl-(ac)
AgNO3(ac) Ag+(ac) + NO3-(ac)
Ag+(ac) + Br-(ac) AgBr(s)
Ag+(ac) + Cl-(ac) AgCl(s)
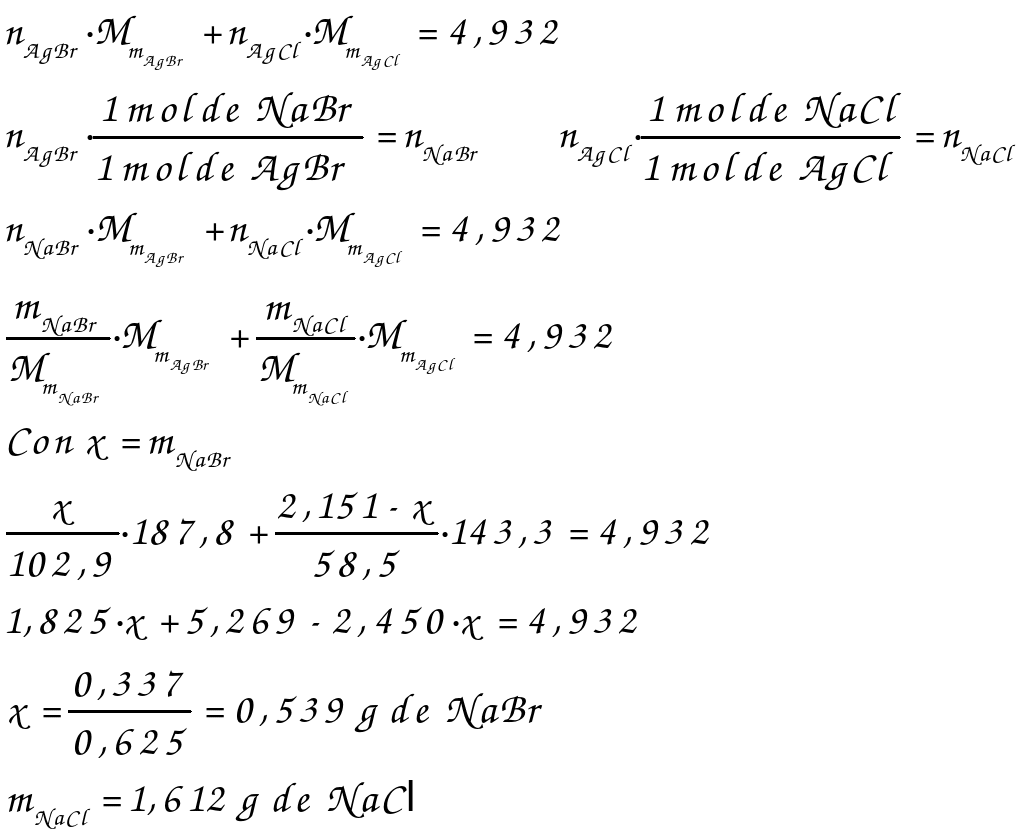
Tags: compuesto orgánico, compuesto, disolución
- MID DEVON DISTRICT COUNCIL CLEAN AIR ACT 1993 –
- EL SEGMENTO DE FLOTAS CHEVROLET YA CUENTA CON SERVICIO
- ENGLESKA GRAMATIKA MIRZA 12142007 ENGLESKA GRAMATIKALIČNE ZAMJENICE (PERSON PRONOUNS
- PREDLOG ZAPISNIKA MAREC 2015 OBČINA MARKOVCI OBČINSKI SVET MARKOVCI
- I Z J A V A ROĐENA GODINE
- 5 REPUBLICA DE CHILE MINISTERIO DE SALUD
- ИМЕ И ПРЕЗИМЕ РАЗМИШЉАНКА 1 ГРИЦКО ЈЕ НИЖИ ОД
- THIS IS A SUMMARY OF THE DISCUSSION YOUR STUDENT
- BİTKİ KORUMA ÜRÜNLERİ KONTROL YÖNETMELİĞİ YETKI KANUNU 5996 YAYIMLANDIĞI
- WHITE PAGE 27 20211115393429DOC PAGE 27 OF 27 SEISMIC
- FANTASY AN INTRODUCTION TO THE GENRE WITH EXAMPLES FROM
- CAMPAÑA CULTURAL –GRUPOS TERUEL 2017 (FICHA DE CONFIRMACIÓN) (1)
- SENATE NO 2843 STATE OF NEW JERSEY 216TH LEGISLATURE
- 6 BETEGTÁJÉKOZTATÓ INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA 1 LIDOCAINADRENALIN 20
- WARSZAWA DNIA 11122018R WWWWATEDUPL NR SPRAWY 195DZZ2018 WYJAŚNIENIE NR
- PIRACTWO MORSKIE – ODRODZENIE ZŁA …… PIERWSZY AUTOR DRUGI
- 4 BLOC DE NOTAS DE WINDOWS TABLA DE CONTENIDOS
- SÍLABO TEORIA DE LA COMUNICACIÓN I DATOS GENERALES FACULTAD
- CLASSIFICATIONS OF REFLEXES A) PRIMITIVE REFLEXES AND GENETIC SUBPROGRAMS
- NÚM 235 MARTES 7 DE DICIEMBRE DE 2010 IV
- ЛЕКЦИЯ № 1 PHONETICS AS A BRANCH OF LINGUISTICS
- EN A DE DE 2012 A LA JUNTA ELECTORAL
- MUSEUMS AND THE VISUALLY IMPAIRED PLACES OF ADAPTATION
- KLAUZULA INFORMACYJNA WYPEŁNIAJĄC OBOWIĄZEK OKREŚLONY W ROZPORZĄDZENIU PARLAMENTU EUROPEJSKIEGO
- LISTA PUNKTÓW ZWROTNYCH – EPBA 2011 3 NR NAME
- PRAVILNIK O NAGRADI STUDENATA OŽUJAK 2014 NA TEMELJU
- CMPA – FL 05| PROC Nº 099816 PLL Nº
- AGREEMENT FOR SUPPLY OF SERVICES—DETAILED PROVISIONS—PROCOUNCIL 1 THIS
- CERTIFICATION OF ZERO INCOME (TO BE COMPLETED BY ADULT
- [DATE] CONTRACTOR NAME CONTRACTOR ADDRESS RE FRAMEWORK FOR CONSULTANCY
 PLANNING COMMISSION AGRICULTURE STRATEGY FOR ELEVENTH PLAN SOME CRITICAL
PLANNING COMMISSION AGRICULTURE STRATEGY FOR ELEVENTH PLAN SOME CRITICAL MACBETH – GUILTY AS CHARGED? MANY DIFFERENT AND OFTEN
MACBETH – GUILTY AS CHARGED? MANY DIFFERENT AND OFTEN M UTALE MUNICIPALITY OLD MANENU PRIVATE BAG X1254 BATTALION
M UTALE MUNICIPALITY OLD MANENU PRIVATE BAG X1254 BATTALIONNOVELA ESPAÑOLA ENTRE 1939 Y 1975 ARGUMENTOS Y NOTAS
 ¿CÓMO AÑADIR MÁS AUTORES AL BLOG? ANTES DE NADA
¿CÓMO AÑADIR MÁS AUTORES AL BLOG? ANTES DE NADAPREVENTIVE AND THERAPEUTIC EFFICACY OF BIOCAN M INACTIVATE VACCINE
CAREER TOPIC ASSIGNMENTS CAREER SERVICES SUPPORTS STUDENTS TO LEARN
PROPUESTA SISTEMA SELECTIVO GRUPO A Y B ADMINISTRACION
 JOB DESCRIPTION DIRECTORATE COMMUNITIES DEPARTMENT STRATEGIC ASSET MANAGEMENT AND
JOB DESCRIPTION DIRECTORATE COMMUNITIES DEPARTMENT STRATEGIC ASSET MANAGEMENT AND GET FILEE430 PROBSOLVING COMPLETE DATASETSAV UNIVARIATE ANALYSIS OF VARIANCE
GET FILEE430 PROBSOLVING COMPLETE DATASETSAV UNIVARIATE ANALYSIS OF VARIANCE“BIR KIŞ GECESI SOKAKTA YAŞAMA EYLEMI” SOKAKLARDA TERKEDİLMİŞ İNSANLARA
TABLE S1 PREPARING FRESHFROZEN TISSUE SECTIONS FOR LASER CAPTURE
 GS1 TECHNICAL XML USER GUIDE TO RELEASE 20 VERSION
GS1 TECHNICAL XML USER GUIDE TO RELEASE 20 VERSION EVIDENCEBASED PROJECT EVIDENCEBASED NURSING PRACTICE TOOLKIT ADAPTED FOR SPARTANBURG
EVIDENCEBASED PROJECT EVIDENCEBASED NURSING PRACTICE TOOLKIT ADAPTED FOR SPARTANBURG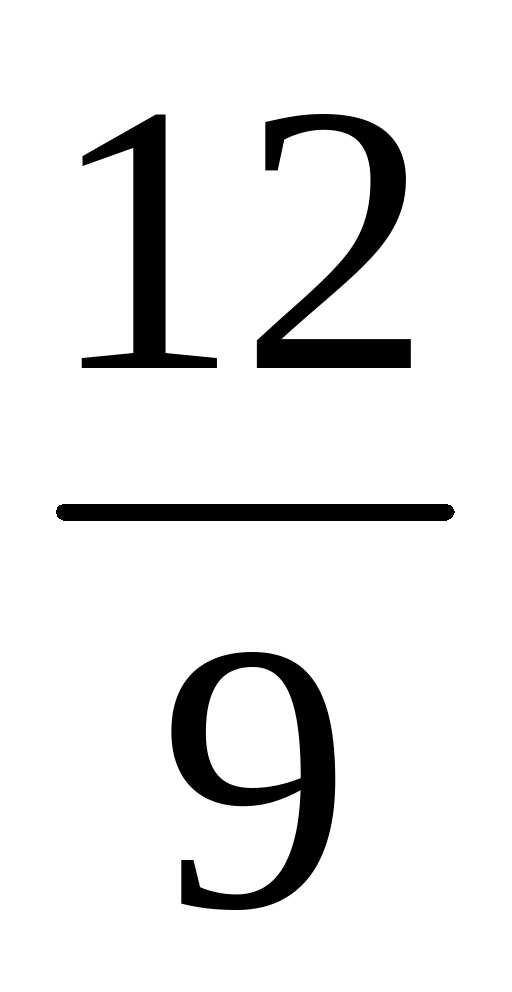 KESİR SAYILARINDA SIRALAMA ALIŞTIRMALARI A AŞAĞIDAKI PAYDALARI EŞIT KESIRLERI
KESİR SAYILARINDA SIRALAMA ALIŞTIRMALARI A AŞAĞIDAKI PAYDALARI EŞIT KESIRLERI PAGE OF MAKE COPIES OF THIS FORM IF
PAGE OF MAKE COPIES OF THIS FORM IFFAKTÚRY FEBRUÁR 2011 ČÍSLO FAKTÚRY NÁZOV DODÁVATEĽA FAKTUROVANÁ SUMA
ULLALENA LUNDBERG DET ÄR HAVSBRUSETS FÖRTJÄNST ATT KÖKARBORNA FÅTT
LITANY OF REMEMBRANCE IN THE RISING OF THE SUN
 U NSCETDG25INF44 PAGE 3 UNSCETDG25INF44 COMMITTEE OF
U NSCETDG25INF44 PAGE 3 UNSCETDG25INF44 COMMITTEE OF